-
CH4和CO2可以制造价值更高的化学产品。已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H1=a kJ·mol-1
CO(g)+H2O(g)=CO2(g)+H2(g) △H2=b kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H3=c kJ·mol-1
则反应CO2(g)+CH4(g) 2CO(g)+2H2(g)的△H用含a、b、c的代数式表示为
2CO(g)+2H2(g)的△H用含a、b、c的代数式表示为
A.a+2b-c B.a+b-2c C.2a+2b-c D.a+2b-2c
-
CH4和CO2可以制造价值更高的化学产品。已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H1=a kJ·mol-1
CO(g)+H2O(g)=CO2(g)+H2(g) △H2=b kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H3=c kJ·mol-1
则反应CO2(g)+CH4(g) 2CO(g)+2H2(g)的△H用含a、b、c的代数式表示为( )
2CO(g)+2H2(g)的△H用含a、b、c的代数式表示为( )
A.a+2b-c B.a+b-2c C.2a+2b-c D.a+2b-2c
-
Ⅰ.CH4和CO2可以制造价值更高的化学产品。已知:
CH4(g)+2O2(g) CO2(g)+2H2O(g) ΔH 1=a kJ/mol
CO2(g)+2H2O(g) ΔH 1=a kJ/mol
CO(g)+H2O(g) CO2(g)+H2(g) ΔH 2=b kJ/mol
CO2(g)+H2(g) ΔH 2=b kJ/mol
2CO(g)+O2(g) 2CO2(g) ΔH 3=c kJ/mol
2CO2(g) ΔH 3=c kJ/mol
(1)求反应CH4(g)+CO2(g) 2CO(g)+2H2(g) ΔH =______kJ/mol(用含a、b、c的代数式表示)。
2CO(g)+2H2(g) ΔH =______kJ/mol(用含a、b、c的代数式表示)。
(2)一定条件下,等物质的量的(1)中反应生成的气体可合成二甲醚(CH3OCH3),同时还产生了一种可参与大气循环的无机化合物,该反应的化学方程式为_______________。
Ⅱ.钠硫电池以熔融金属Na、熔融S和多硫化钠(Na2Sx )分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示:
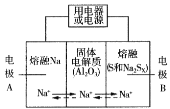
Na2Sx  2Na+xS (3<x<5)
2Na+xS (3<x<5)
| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050 |
| 沸点/℃ | 892 | 444.6 | 2980 |
(3)根据上表数据,判断该电池工作的适宜温度应为______________(填字母序号)。
A.100℃以下 B.100℃~300℃
C.300℃~350℃ D.350℃~2050℃
(4)关于钠硫电池,下列说法正确的是______(填字母序号)。
A.放电时,电极A为负极
B.放电时,Na+的移动方向为从B到A
C.充电时,电极A应连接电源的正极
D.充电时电极B的电极反应式为 −2e−
−2e− xS
xS
(5)25℃时,若用钠硫电池作为电源电解500mL 0.2mol/L NaCl溶液,当溶液的c(OH-)=0.1mol/L时,电路中通过的电子的物质的量为_________mol,两极的反应物的质量差为_________g。(假设电解前两极的反应物的质量相等)
III.(6)在标准状态即压力为100kPa,一定温度下,由元素最稳定的单质生成生成 1mol 纯化合物时的反应热称为该化合物的标准摩尔生成焓(ΔfHΘm)。已知 100kPa,一定温度下:
Fe2 O 3(s)+3C(石墨)=2Fe(s)+3CO(g) △H=+490.0 kJ/mol
CO(g)+1/2O2(g)=CO2 (g) △H=-280.0kJ/mol
C(石墨)+O2 ( g)=CO2 (g) △H=-390.5kJ/mol
则 Fe2O3 的标准摩尔生成焓ΔfHΘm=__________________。
-
CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值的化学品是目前的研究方向。
(1)已知:CH4(g) + 2O2(g)=CO2(g) + 2H2O(g) ΔH1 = a kJ•mol-1
CO(g) + H2O (g)=CO2(g) + H2 (g) ΔH2 = b kJ•mol-1
2CO(g) + O2(g)=2CO2(g) ΔH3 = c kJ•mol-1
反应CO2(g) + CH4(g) 2CO(g) + 2H2(g) 的ΔH= kJ•mol-1。
2CO(g) + 2H2(g) 的ΔH= kJ•mol-1。
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
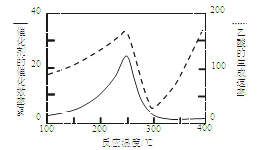
① 在不同温度下催化剂的催化效率与乙酸的生成速率如图8所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是 。
② 为了提高该反应中CH4的转化率,可以采取的措施是 。
③ 将Cu2Al2O4溶解在稀硝酸中的离子方程式为 。
(3)以CO2为原料可以合成多种物质。
① 利用FeO吸收CO2的化学方程式为:6FeO + CO2=2Fe3O4 + C,则反应中每生成1molFe3O4,转移电子的物质的量为 mol。
② 以氢氧化钾水溶液作电解质进行电解,在铜电极上CO2可转化为CH4,另一电极石墨连接电源的 极,则该电解反应的化学方程式为
-
已知化学能与其他形式的能可以相互转化,下列反应中能量的转化形式是由化学能转化为热能的是
A.CH4+2O2  CO2+2H2O B.CaCO3
CO2+2H2O B.CaCO3  CaO+CO2↑
CaO+CO2↑
C.2H2O  2H2↑ + O2↑ D.Pb+PbO2+2H2SO4
2H2↑ + O2↑ D.Pb+PbO2+2H2SO4  2PbSO4+2H2O
2PbSO4+2H2O
-
已知化学能与其他形式的能可以相互转化,下列反应中能量的转化形式是由化学能转化为热能的是 ( )
A.CH4+2O2  CO2+2H2O
CO2+2H2O
B.CaCO3  CaO+CO2↑
CaO+CO2↑
C.2H2O  2H2↑ + O2↑
2H2↑ + O2↑
D.
-
已知化学能与其他形式的能量可以相互转化,下列反应中能量的转化形式是由化学能转化为热能的是
A.CH4+2O2  CO2+2H2O
CO2+2H2O
B.CaCO3  CaO+CO2↑
CaO+CO2↑
C.2H2O  2H2↑ + O2↑
2H2↑ + O2↑
D.Pb+PbO2+2H2SO4 2PbSO4+2H2O
2PbSO4+2H2O
-
已知化学能与其他形式的能可以相互转化,下列反应中能量的转化形式是由化学能转化为热能的是
A.CH4+2O2 CO2+2H2O
CO2+2H2O
B.CaCO3 CaO+CO2↑
CaO+CO2↑
C.2H2O  2H2↑ + O2↑
2H2↑ + O2↑
D.Pb+PbO2+2H2SO4  2PbSO4+2H2O
2PbSO4+2H2O
-
已知下列热化学方程式:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.5 kJ·mol-1
②2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l) ΔH=-3199.6 kJ·mol-1
③C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) ΔH=-1411 kJ·mol-1
④2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH=-2599.2 kJ·mol-1
⑤C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) ΔH=-2219.9 kJ·mol-1
现有2 mol由上述五种物质中的两种组成的气体混合物,经充分燃烧后放出2970.8kJ热量,则下列哪些组合是可能的
A. CH4和C2H2 B. C2H4和C3H8 C. C2H6和C3H8 D. C2H4和C2H2
-
下列热化学方程式书写正确的是
A. 已知甲烷的燃烧热为890.3 kJ‧mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ‧mol-1
B. 已知强酸和强碱的稀溶液反应的中和热为57.3 kJ‧mol-1,则CH3COOH+OH—=CH3COO—+H2O ΔH=-57.3 kJ‧mol-1
C. 一定条件下,将0.5mol N2和1.5mol H2置于密闭容器中,充分反应生成NH3(g),放出热量19.3kJ,其热化学方程式为:N2(g)+3H2(g) 2NH3(g) ΔH=-38.6 kJ‧mol-1
2NH3(g) ΔH=-38.6 kJ‧mol-1
D. 已知1g N2H4(l)和足量H2O2(l)反应生成氮气和水蒸气,放出热量20.05kJ,该热化学方程式可表示为:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) ΔH=-641.6 kJ‧mol-1
CO2(g)+2H2O(g) ΔH 1=a kJ/mol
CO2(g)+H2(g) ΔH 2=b kJ/mol
2CO2(g) ΔH 3=c kJ/mol
2CO(g)+2H2(g) ΔH =______kJ/mol(用含a、b、c的代数式表示)。

2Na+xS (3<x<5)
−2e−
xS
