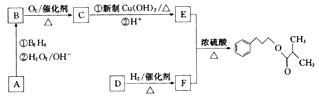
-
NaNO2是一种食品添加剂,它与酸性KMnO4溶液可发生反应:MnO4-+NO2-+X→Mn2++NO3-+H2O(未配平)。下列叙述中正确的是
A. 生成1mo1NaNO3需消耗0.4mo1KMnO4
B. 反应过程中溶液的pH减小
C. 该反应中NO2﹣被还原
D. X可以是盐酸
难度: 困难查看答案及解析
-
化学与生产、生活密切相关,下列说法不正确的是
A. 游泳场馆常用硫酸铜作池水消毒剂
B. 硅胶可用作商品包装袋内的干燥剂,也可以用作催化剂的载体
C. 铝表面有一层致密的氧化膜,故铝制容器可以用来腌制咸菜等
D. 《开宝本草》中记载:“此即地霜也,所在山泽,冬月地上有霜,扫取以水淋汁后,乃煎炼而成”。文中对硝酸钾提取没有涉及到升华操作
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A. 饱和碳酸钠溶液中析出1.06g晶体,该晶体中含有2 NA个Na+
B. 1mol乙酸与足量的乙醇发生酯化反应,生成乙酸乙酯分子数为NA个
C. 某温度下,1L pH=2的H2SO4溶液中,硫酸和水电离的H+总数为0.01NA
D. 常温常压下,NO2与N2O4的混合气体46g,分子总数为NA
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是
A. 强酸性溶液中:Cu2+、K+、ClO-、SO42-
B. PH=6的溶液中:Fe3+、Al3+、SO42-、Cl-
C. 含有大量AlO2-的溶液中:K+、Na+、HCO3-、I-
D. 有色透明溶液中:Fe2+、Ba2+、Cl-、NO3-
难度: 中等查看答案及解析
-
下列变化一定属于化学变化的是( )
①金属导电 ②爆炸 ③缓慢氧化 ④SO2使品红溶液褪色 ⑤无水硫酸铜由白变蓝 ⑥工业制O2 ⑦白磷转化为红磷 ⑧久置浓硝酸变黄 ⑨16O与18O间的相互转化 ⑩煤的干馏和石油的分馏 ⑪石油化工中的裂化、裂解
A. ②④⑦⑧⑨ B. ③④⑤⑦⑧⑪
C. ①③⑥⑨⑩⑪ D. ①②⑤⑥⑩⑪
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A. 干冰升华和液氧气化时,都只需克服分子间作用力
B. N2和Cl2O两种分子中,每个原子的最外层都具有8电子稳定结构
C. HF、HCl、HBr、HI的热稳定性和水溶液的酸性均依次减弱
D. 石墨转化金刚石,既有化学键的断裂,又有化学键的形成
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. CCl4不能燃烧,常用作灭火剂
B. 1mol 葡萄糖能水解生成2molCH3CH2OH和2molCO2
C. 石油是复杂的混合物,通过分馏可以获得汽油、煤油等,通过催化重整可以获得乙烯、丙烯等
D. 用玻璃棒蘸取牛油与氢氧化钠反应后的液体,滴入沸水中,若没有油状液体浮在水面,则说明皂化反应已经完全
难度: 中等查看答案及解析
-
下列有关物质性质与用途具有对应关系的是( )
A. SO2具有氧化性,常用于漂白秸秆、织物
B. 明矾水解形成Al(OH)3胶体,可用作水处理中的消毒剂
C. 白葡萄酒含维生素C 等多种维生素,通常添加微量SO2,以防止营养成分被氧化
D. 次氯酸有酸性,可用于自来水的杀菌消毒
难度: 中等查看答案及解析
-
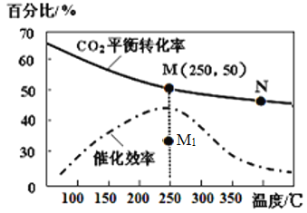
下图是金属镁和卤素单质(X2)反应的能量变化示意图。下列说法正确的是( )
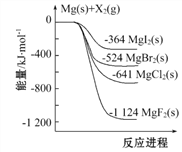
A. 由图可知此温度下MgBr2(s)与Cl2(g)反应的热化学方 程式为:MgBr2(s)+Cl2(g)
MgCl2(s)+Br2(g) ΔH=+117 kJ·mol-1
B. 热稳定性: MgI2 > MgBr2 > MgCl2 > MgF2
C. 工业上可由电解MgCl2溶液冶炼金属Mg,该过程需吸收热量
D. 金属镁和卤素单质(X2)的反应能自发进行是因为ΔH均小于零
难度: 困难查看答案及解析
-
实验室欲制取适量NO2气体,下图中最适合完成该实验的简易装置是
A.
 B.
B.  C.
C. 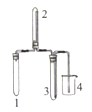 D.
D. 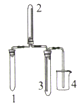
难度: 困难查看答案及解析
-
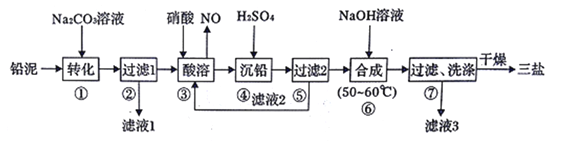
海水开发利用的部分过程如图所示。下列说法不正确的是( )
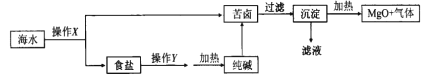
A. 操作X是蒸发、结晶、过滤、洗涤
B. 操作y是先将NH3通入饱和食盐水,再不断通入CO2
C. 沉淀主要成分为Mg(OH)2
D. 气体及滤液可用于制备纯碱
难度: 中等查看答案及解析
-
20℃时,在H2C2O4、NaOH混合溶液中,c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol/L。含碳元素微粒的分布分数δ随溶液pH变化的关系如图所示。下列说法正确的是
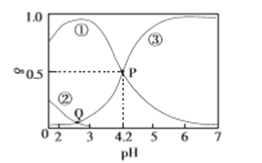
A. ①表示H2C2O4的分布曲线,③表示C2O42-的分布曲线
B. Q点对应的溶液中lgc(H+)<lgc(OH-)
C. 20℃时,H2C2O4的一级电离平衡常数Ka1=1×10-4.2
D. 0.100mol/L的NaHC2O4溶液中:c(OH-)=c(H+)- c(C2O42-)+c(H2C2O4)
难度: 中等查看答案及解析
-
X、Y、Z、W是短周期主族元素,X原子最外层电子数是其内层电子数的3倍;Y的原子序数是其最外层电子数的6倍;Z的一种单质是自然界中最硬的物质;自然界中,W的单质多出现在火山口附近,且为淡黄色晶体。下列叙述正确的是( )
A. 原子半径的大小:Z>X > Y
B. Z的氢化物的沸点一定比X 的低
C. W的最高价氧化物对应水化物的酸性在同主族中最强
D. Y的单质可通过铝热反应冶炼
难度: 困难查看答案及解析
-
已知100℃时,水的离子积常数Kw=1×10-12,对于该温度下pH=l1的氨水,下列叙述正确的是
A. 向该溶液中加入同温同体积pH=1的盐酸,反应后溶液呈中性
B. 温度降低至25℃,该氨水溶液中H2O电离出的H+浓度小于10-11mol/L
C. 该氨水溶液中加入NH4Cl溶液,NH3·H2O的电离能力增强
D. 滴加等浓度等体积的硫酸,得到的溶液中存在电离平衡:NH4HSO4(aq)
NH4+(aq)+H+(aq)+SO42-(aq)
难度: 中等查看答案及解析
-
有机物a和苯通过反应合成b的过程如图(无机小分子产物略去)。下列说法正确的是
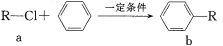
A. 该反应是加成反应
B. 若R为CH3时,b中所有原子可能共面
C. 若R为C4H9时,取代b苯环上的氢的一氯代物的可能的结构共有4种
D. 若R为C4H5O时,1molb最多可以与5molH2加成
难度: 中等查看答案及解析
-
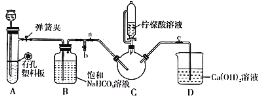
Y形管是一种特殊的仪器,与其他仪器组合可以进行某些实验探究。利用下图装置可以探究SO2与BaCl2反应生成BaSO3沉淀的条件。下列判断正确的是
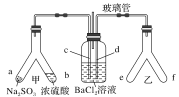
A. 玻璃管的作用是连通大气,使空气中的氧气进入广口瓶,参与反应
B. c、d两根导管都必须插入BaCl2溶液中,保证气体与Ba2+充分接触
C. Y形管乙中产生的为氧化性气体,将BaSO3氧化为BaSO4沉淀
D. e、f两管中的试剂可以分别是浓氨水和NaOH固体
难度: 困难查看答案及解析
-
某工厂的污水中可能含有NH4+、Fe2+、Cl-、Fe3+、SO42-、HCO3-离子中的一种或几种,为检验上述离子,某兴趣小组设计了如下实验方案, 下列说法正确的是
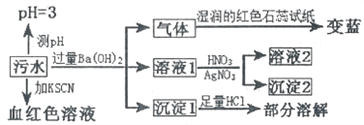
A. 沉淀l为BaCO3和BaSO4
B. 沉淀2可能为AgCl和Ag2SO4
C. 该污水中一定存在Fe3+,不存在Fe2+
D. 该污水中一定存在NH4+、Cl-、Fe3+、SO42-离子
难度: 困难查看答案及解析
-
锂-空气电池原理模型如图所示,下列说法不正确的是
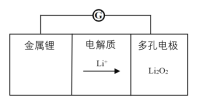
A. 电池正极可以吸附空气中氧气作为氧化剂
B. 正极反应为2Li+ + O2 + 2e-
Li2O2
C. 电解质能传递锂离子和电子,不可以用水溶液
D. 负极反应Li - e-=Li+
难度: 中等查看答案及解析
-
下列实验方案、现象、得出的结论均正确的是( )
选项
实验及现象
结论
A
用玻璃棒蘸取某样品进行焰色反应时观察到黄色火焰
该样品含钠元素
B
向NaHCO3溶液中加入过量盐酸振荡、静置、有气泡产生
证明非金属性:Cl>C
C
向酸化的KMnO4溶液通入S02,向反应后的溶液中加入BaCl2产生白色沉淀
证明S02被氧化为SO42-
D
将10mL 2mol/L的KI溶液与1 mL 1mol/LFeCl3溶液混合充分反应后滴加KSCN,溶液颜色变红
KI与FeCl3反应有可逆性
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
下列各实验的叙述不正确的是( )
A. 以酚酞作指示剂,用一定浓度的NaOH溶液滴定一定体积、一定浓度的草酸溶液[已知K1(H2C2O4)=5.4×10-2、K2(H2C2O4)=6.4×10-5] 证明草酸是二元酸
B. 将液溴、苯、FeBr3混合于烧瓶中制备溴苯
C. 常温下,用精密PH试纸分别测定浓度均为0.1mol/L的NaClO溶液和CH3COONa溶液的PH比较HClO和CH3COOH的酸性强弱
D. 钾在空气中燃烧的实验操作:将一干燥的坩埚加热,同时取一小块钾,滤纸吸干表面的煤油后,迅速投到热坩埚中,观察现象
难度: 中等查看答案及解析