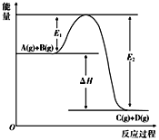
-
在下列各说法中,正确的是( )
A. ΔH>0表示放热反应,ΔH<0表示吸热反应
B. 1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热
C. 热化学方程式中的化学计量数只表示物质的量,可以是分数
D. 1 mol H2SO4与1 mol Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热
难度: 中等查看答案及解析
-
已知25 ℃、101 kPa条件下:
①4Al(s)+3O2(g)===2Al2O3(s) ΔH=−2 834.9 kJ·mol−1
②4Al(s)+2O3(g)===2Al2O3(s) ΔH=−3 119.1 kJ·mol−1
由此得出的正确结论是
A. 等质量的O2比O3能量低,由O2变O3为吸热反应
B. 等质量的O2比O3能量高,由O2变O3为放热反应
C. O3比O2稳定,由O2变O3为吸热反应
D. O2比O3稳定,由O2变O3为放热反应
难度: 中等查看答案及解析
-
化学与生活密切相关。下列分析不正确的是( )
A. “煮豆燃豆萁,豆在釜中泣”句中涉及的能量变化主要是化学能转化为热能和光能
B. 食品添加剂可以改善食品品质及延长食品保存期,在添加时无需对其用量进行严格控制
C. “一带一路”是“丝绸之路经济带”和“21世纪海上丝绸之路”的简称。丝绸的主要成分是蛋白质
D. 绿色化学是指在化学产品的设计、开发和加工生产过程中减少使用或产生对环境有害物质的科学
难度: 中等查看答案及解析
-
关于化学能与其他能量相互转化的说法正确的是( )
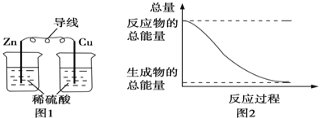
A. 图1所示的装置能将化学能转变为电能
B. 图2所示的反应为吸热反应
C. 中和反应中,反应物的总能量比生成物的总能量低
D. 化学反应中能量变化的主要原因是化学键的断裂与形成
难度: 中等查看答案及解析
-
2014年7月21日,世界各国领导人在南非德班共同商讨应对气候变化的道路—“拯救人类的最后机会”。要想节能减排下列属最有希望的新能源是( )
①天然气 ②煤 ③石油 ④水能 ⑤太阳能 ⑥地热能 ⑦风能 ⑧氢能
A. ①②③④ B. ⑤⑥⑦⑧ C. ③④⑤⑥ D. 除①②外
难度: 简单查看答案及解析
-
下列各组物质的燃烧热相等的是
A. C和CO B. 红磷和白磷
C. 3molC2H2(乙炔)和1molC6H6(苯) D. 1gH2和2gH2
难度: 中等查看答案及解析
-
某反应使用催化剂后,其反应过程中能量变化如图所示。下列说法错误的是
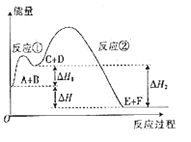
A. 该反应的总反应为放热反应 B. 使用催化剂,只以改变反应进行的方向
C. 反应①是吸热反应,反应②是放热反应 D. △H=△H1+△H2
难度: 简单查看答案及解析
-
25℃、101 kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ·mol-1,下列热化学方程式书写正确的是( )
A. 1/2Ba(OH)2(aq)+1/2H2SO4(aq)
1/2BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
B. 1/2KOH(aq)+H2SO4(aq)
1/2K2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
C. 2NaOH(aq)+H2SO4(aq)
Na2SO4(aq)+2H2O(l) ΔH=-57.3 kJ·mol-1
D. KOH(aq)+1/2H2SO4(浓)
1/2K2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
难度: 中等查看答案及解析
-
某学生用如图所示装置进行化学反应X+2Y
2Z能量变化情况的研究。当往试管中滴加试剂Y时,看到U形管中液面甲处降、乙处升。关于该反应的下列叙述中正确的是

①该反应为放热反应;②该反应为吸热反应;③生成物的总能量比反应物的总能量更高;④反应物的总能量比生成物的总能量更高;⑤该反应过程可以看成是“贮存“于X、Y内部的部分能量转化为热能而释放出来。
A. ①④⑤ B. ①④ C. ①③ D. ②③⑤
难度: 中等查看答案及解析
-
“长征二号”系列火箭用的燃料是液态的偏二甲肼(C2H8N2),氧化剂是液态的N2O4,已知1.5g偏二甲基肼完全燃烧生成N2、CO2和液态H2O放出热量50kJ热量。下列说法不正确的是( )
A. 燃料在火箭发动机中燃烧是将化学能主要转变为热能和机械能
B. 液态N2O4气化时共价键没被破坏
C. 依题可知C2H8N2的燃烧热为50kJ/mol
D. 偏二甲基肼在N2O4中燃烧时的化学方程式为:C2H8N2+2N2O4
2CO2+3N2+4H2O
难度: 中等查看答案及解析
-
反应A→C分两步进行:①A→B,②B→C。反应过程能量变化曲线如图所示(E1、E2、E3、E4表示活化能)。下列说法错误的是( )

A. 三种物质中B最不稳定 B. A→B反应的活化能为E1
C. B→C反应的ΔH=E4-E3 D. 加入催化剂不能改变反应的焓变
难度: 困难查看答案及解析
-
联氨(N2H4)常温下为无色液体,可用作火箭燃料。下列说法不正确的是
①2O2(g)+N2(g)===N2O4(l) ΔH1
②N2(g)+2H2(g)===N2H4(l) ΔH2
③O2(g)+2H2(g)===2H2O(g) ΔH3
④2N2H4(l)+N2O4(l)===3N2(g)+4H2O(g) ΔH4=﹣1048.9 kJ·mol−1
A. O2(g)+2H2(g)===2H2O(l) ΔH5,ΔH5>ΔH3
B. ΔH4=2ΔH3﹣2ΔH2﹣ΔH1
C. 1 mol O2(g)和2 mol H2(g)具有的总能量高于2 mol H2O(g)
D. 联氨和N2O4作火箭推进剂的原因之一是反应放出大量的热
难度: 中等查看答案及解析
-
下列过程中生成物的总能量高于反应物的总能量的是
A. 2Al+Fe2O3
2Fe +Al2O3 B. CaO+H2O=Ca(OH)2
C. 2Na + 2H2O =2NaOH+H2↑ D. H—Br → H + Br
难度: 中等查看答案及解析
-
C6H12O6(s)、C8H18(1)燃烧热分别是2800kJ·mol-1、5518 kJ·mol-1,下列热化学方程式正确的是( )
A. C6H12O6(s)+6O2(g)
6CO2(g)+6H2O(g) △H=-2800kJ·mol-1
B. 0.5C6H12O6(s)+3O2(g)
3CO2(g)+3H2O(l) △H=-1400kJ·mol-1
C. C8H18+12.5O2
8CO2+9H2O △H=-5518kJ·mol-1
D. C8H18(1)+12.5O2(g)
8CO2(g)+9H2O(1) △H=+5518kJ·mol-1
难度: 中等查看答案及解析
-
下列说法或表示法正确的是
A. 等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B. 由C(石墨)→C(金刚石) ΔH =" +119" kJ·mol—1可知,金刚石比石墨稳定
C. 在稀溶液中:H++OH-===H2O ΔH = -57.3 kJ· mol—1,若将含1mol CH3COOH的醋酸溶液与含1 mol NaOH的溶液混合,放出的热量小于57.3 kJ
D. 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+ O2(g)==2H2O(l) ΔH =" +285.8" kJ· mol—1
难度: 中等查看答案及解析
-
下图是金属镁和卤素单质(X2)反应的能量变化示意图。下列说法正确的是( )
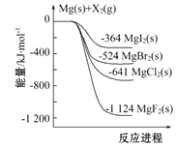
A. 金属镁和卤素单质(X2)的反应能自发进行是因为ΔH均小于零
B. 热稳定性:MgI2 >MgBr2 >MgCl2 >MgF2
C. 工业上可由电解MgCl2溶液冶炼金属Mg,该过程需吸收热量
D. 由图可知此温度下MgBr2(s)与Cl2(g)反应的热化学方程式为:MgBr2(s)+Cl2(g)
MgCl2(s)+Br2(g)△H=+117kJ·mol-1
难度: 困难查看答案及解析