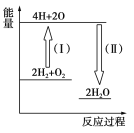
-
已知25 ℃、101 kPa条件下:
①4Al(s)+3O2(g)===2Al2O3(s) ΔH=−2 834.9 kJ·mol−1
②4Al(s)+2O3(g)===2Al2O3(s) ΔH=−3 119.1 kJ·mol−1
由此得出的正确结论是
A. 等质量的O2比O3能量低,由O2变O3为吸热反应
B. 等质量的O2比O3能量高,由O2变O3为放热反应
C. O3比O2稳定,由O2变O3为吸热反应
D. O2比O3稳定,由O2变O3为放热反应
难度: 中等查看答案及解析
-
下列反应中生成物总能量高于反应物总能量的是( )
A. 氧化钙与水反应 B. 乙醇的燃烧 C. 铝粉与氧化铁粉末反应 D. 碳酸钙受热分解
难度: 中等查看答案及解析
-
通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。现给出化学键的键能(见下表):
化学键
H—H
Cl—Cl
Cl—H
键能/(kJ·mol-1)
436
243
431
请计算H2(g)+Cl2(g)===2HCl(g)的反应热( )
A. +862 kJ·mol-1 B. +679 kJ·mol-1 C. -183 kJ·mol-1 D. +183 kJ·mol-1
难度: 中等查看答案及解析
-
已知化学反应A2(g) + B2(g) ="==" 2AB(g)的能量变化如图所示,判断下列叙述中正确的是( )
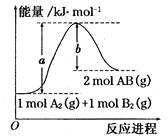
A.每生成2分子AB吸收bkJ热量
A. 该反应热△H=+(a-b)kJ/mol
B. 该反应中反应物的总能量高于生成物的总能量
C. 断裂1molA—A和1molB—B键,放出akJ能量
难度: 中等查看答案及解析
-
lmol碳完全燃烧后可放出393.5KJ的热量,下列热化学方程式正确的是( )
A. C(s)+O2(g)=CO2(g) △H=+393.5kJ/mol
B. C(s)+
O2(g)=CO(g) △H=﹣393.5kJ/mol
C. C+O2=CO2 △H=﹣393.5kJ/mol
D. C(s)+O2(g)=CO2(g) △H=﹣393.5kJ/mol
难度: 简单查看答案及解析
-
下列说法或表示法不正确的是( )
A. 等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B. 由C(石墨)→C(金刚石) ΔH = +1.9 kJ·mol—1可知石墨比金刚石稳定
C. 在稀溶液中:H++OH-
H2O ΔH =-57.3 kJ·mol—1,若将含1mol CH3COOH的醋酸溶液与含1 mol NaOH的溶液混合,放出的热量小于57.3 kJ
D. 在热化学方程式中无论是反应物还是生成物必须表明聚集状态
难度: 中等查看答案及解析
-
已知强酸与强碱的稀溶液发生中和反应的热化学方程式为 H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,又知电解质的电离是吸热过程。向1 L 0.5 mol·L-1的NaOH溶液中加入下列物质:①稀醋酸;②浓硫酸;③稀硝酸,恰好完全反应。则其焓变ΔH1、ΔH2、ΔH3的关系是( )
A. ΔH1>ΔH2>ΔH3 B. ΔH1<ΔH3<ΔH2 C. ΔH1=ΔH3>ΔH2 D. ΔH1>ΔH3>ΔH2
难度: 中等查看答案及解析
-
下表中列出了25℃、101kPa时一些物质的燃烧热数据
物质
CH4
C2H2
H2
燃烧热/kJ/mol
890.3
1299.6
285.8
已知键能:C—H键:413.4 kJ/mol、H—H键:436.0 kJ/mol。
则下列叙述正确的是
A. C≡C键能为796.0 kJ/mol
B. C—H键键长小于H—H键
C. 2H2(g)+O2(g)=2H2O(g) △H=﹣571.6 kJ/mol
D. 2CH4(g)=C2H2(g) +3H2(g) △H=﹣376.4 kJ/mol
难度: 中等查看答案及解析
-
以下几个热化学方程式,能表示有关物质燃烧时的燃烧热的热化学方程式是( )
A. C(s)+1/2O2(g)===CO(g) ΔH=+110.5 kJ·mol-1
B. C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
C. 2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
D. H2(g)+1/2O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1
难度: 中等查看答案及解析
-
能源问题是人类社会面临的重大课题,H2、CO、CH3OH都是重要的能源物质,它们的燃烧热依次为285.8kJ·mol-1、282.5kJ·mol-1、726.7kJ·mol-1。已知CO和H2在一定条件下可以合成甲醇CO(g)+2H2(g)===CH3OH(l)。则CO与H2反应合成甲醇的热化学方程式为( )
A. CO(g)+2H2(g)===CH3OH(l) ΔH=-127.4kJ·mol-1
B. CO(g)+2H2(g)===CH3OH(l) ΔH=+127.4kJ·mol-1
C. CO(g)+2H2(g)===CH3OH(g) ΔH=-127.4kJ·mol-1
D. CO(g)+2H2(g)===CH3OH(g) ΔH=+127.4kJ·mol-1
难度: 困难查看答案及解析
-
灰锡(以粉末状存在)和白锡是锡的两种同素异形体。已知:
①Sn (s、白)+2HCl (aq)=SnCl2 (aq)+H2 (g);DH1
②Sn (s、灰)+2HCl (aq)=SnCl2 (aq)+H2 (g);DH2
③Sn (s、灰)
Sn (s、白);DH3=+2.1 kJ/mol
下列说法正确的是( )
A. DH1>DH2
B. 锡在常温下以灰锡状态存在
C. 灰锡转化为白锡的反应是放热反应
D. 锡制器皿长期处于低于13.2 ℃的环境中,会自行毁坏
难度: 中等查看答案及解析
-
已知:1 mol晶体硅中含有2 mol Si—Si键。工业上可通过下列反应制取高纯硅:SiCl4(g)+2H2(g)
Si(s)+4HCl(g),根据下表列举的化学键的键能数据,判断该反应的反应热(ΔH)为( )
化学键
Si—O
Si—Cl
H—H
H—Cl
Si—Si
Si—C
键能/kJ·mol-1
460
360
436
431
176
347
A. +412 kJ·mol-1 B. -412 kJ·mol-1 C. +236 kJ·mol-1 D. -236 kJ·mol-1
难度: 中等查看答案及解析