-
请你运用所学的化学知识判断,下列有关叙述错误的是 ( )
A. 几千万年前地球上一条恐龙体内的某个原子可能在你的身体里
B. 用斧头将木块一劈为二,在这个过程中个别原子恰好分成更小微粒
C. 金属元素与非金属元素能形成共价化合物
D. 目前使用的元素周期表中,最长的周期含有32种元素
难度: 简单查看答案及解析
-
某元素X的原子序数为52,下列叙述正确的是( )
A. X的最高价氧化物对应水化物的酸性比HBrO4的酸性强
B. X形成的气态氢化物比H2S稳定
C. X原子的得电子能力比碘原子的得电子能力强
D. X的主要化合价是-2、+4、+6
难度: 简单查看答案及解析
-
同主族元素形成的同一类型化合物,往往其结构和性质相似。PH4I是一种白色晶体,下列对PH4I的叙述中,正确的是( )
A. 它是一种共价化合物
B. 它受热时,不能分解产生有色气体
C. 它不可能与NaOH溶液反应
D. 它既含离子键又含共价键
难度: 简单查看答案及解析
-
在一定温度下的某容积可变的密闭容器中,建立下列化学平衡:C(s)+H2O(g)
CO(g)+H2(g)。可认定上述可逆反应在一定条件下已达到化学平衡状态的是
A. 体系的压强不再发生变化
B. 2v正(CO)=v逆(H2O)
C. 生成n molCO的同时生成n mol H2
D. 1 mol H-H键断裂的同时断裂2 mol H-O键
难度: 中等查看答案及解析
-
下面的烷烃是烯烃R和氢气发生加成反应后的产物,则R可能的结构简式有( )

A. 4种 B. 5种 C. 6种 D. 7种
难度: 困难查看答案及解析
-
近来,科学家研制了一种新型的乙醇电池,它用磺酸类质子作溶剂,在2000C左右时供电,乙醇电池比甲醇电池效率高出32倍且更加安全。电池总反应式为:C2H5OH+3O2→
2CO2+3H2O。下列说法不正确的是( )
A.C2H5OH在电池的负极上参加反应
B.1mol乙醇被氧化转移6mol电子
C.在外电路中电子由负极沿导线流向正极
D.电解质溶液中阳离子移向正极,阴离子移向负极
难度: 中等查看答案及解析
-
下列有关判断正确的是( )
A. 由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-=Cu2+
B. 由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+3OH-=Al(OH)3
C. 由Al、Cu、浓硝酸组成原电池,片刻后其负极反应式为:Cu-2e-=Cu2+
D. 原电池装置能够实现2HCl+Cu=CuCl2+H2↑反应
难度: 中等查看答案及解析
-
下列电子式书写正确的是 ( )
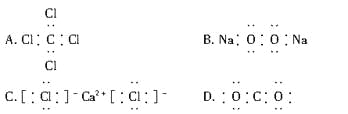
难度: 中等查看答案及解析
-
为了比较铁和铜金属活动性强弱,某研究小组的同学设计了如下一些方案,并将实验结果记录如下:
方案
现象或产物
①将铁片置于CuSO4溶液中
铁片上有亮红色物质析出
②将铁丝和铜丝分别在氯气中燃烧
产物分别为FeCl3和CuCl2
③将铁片和铜片分别放入热浓硫酸中
产物分别为Fe2(SO4)3和CuSO4
④将铁片和铜片分别置于稀硫酸溶液中
铁片上有气泡,铜片上不产生气泡
能根据以上各种现象或产物证明铁的金属活动性比铜强的方案是
A. ①③ B. ①②④ C. ①④ D. ①③④
难度: 简单查看答案及解析
-
可逆反应2NO2(g)
2NO(g)+O2(g)在体积固定的密闭容器中,达到平衡状态的标志是( )
①单位时间内生成nmol O2的同时生成2nmol NO2
②单位时间内生成nmol O2的同时生成2nmol NO
③用NO2、NO、O2表示的反应速率的比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
A. ①④⑥⑦ B. ②③⑤⑦
C. ①③④⑤ D. 全部
难度: 中等查看答案及解析
-
下列各对物质属于同系物的是( )
A. CH2=CHCH3和CH2=CH2 B. CH2ClCH3和CH2ClCH(CH3)CH2Cl
C. CH2=CH2和
D. 12C和14C
难度: 简单查看答案及解析
-
一种11H、21H是氢元素的两种核素,168O、188O是氧元素的两种核素,NA表示阿伏加德罗常数,下列说法中正确的是( )
A. 168O、188O的核外电子排布不相同
B. 通过化学反应,可以实现168O和188O之间的相互转化
C. 18g11H2168O中所含电子数为10NA
D. 18g21H2168O中含中子数为10NA
难度: 中等查看答案及解析
-
A、B、C、D为四种短周期元素,已知A、C同主族,B、C、D同周期;A的气态氢化物比C的气态氢化物稳定;B的阳离子比D的阳离子氧化性强;B的阳离子比C的阴离子少一个电子层。下列叙述正确的是( )
A. 原子序数:A>C>B>D B. 单质熔点:D>B, A>C
C. 原子半径:D>B>C>A D. 简单离子半径:D>B>C>A
难度: 中等查看答案及解析
-
对于反应4NH3+5O2=4NO+6H2O,下列为4种不同情况下测得的反应速率中,表明该反应进行最快的是
A. v(NH3)=0.2 mol/(L·s) B. v(O2)=1.4 mol/(L·min)
C. v(H2O)=0.25 mol/(L·s) D. v(NO)=9 mol/(L·min)
难度: 简单查看答案及解析
-
已知X元素的某种同位素的氯化物XCln为离子化合物,在该化合物中X元素的微粒的核内中子数为m,核外电子数为y,则该同位素的符号是 ( )
A.
B.
C.
D.
难度: 简单查看答案及解析
-
A、B、C均为短周期元素,它们在周期表中的位置如图所示。已知:B元素原子最外层电子数等于A元素原子核外电子总数的1/2。则A、B、C分别是
A. N、Si、S B. C、Al、P C. O、P、Cl D. F、S、Ar
难度: 简单查看答案及解析
-
1mol某烷烃完全燃烧消耗的O2为11 mol,则其主链上含有5个碳原子的同分异构体(不考虑空间异构)有( )
A. 3种 B. 6种 C. 5种 D. 7种
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W,它们的原子序数依次增大,X与Z同主族,并且原子序数之和为20,Y原子的质子数为Z原子的质子数的一半,W原子的最外层电子数比Y原子的最外层电子数多2个,下列叙述正确的是( )
A. 原子半径Z>W>Y>X
B. 气态氢化物的稳定性Z>W
C. Y的最高价氧化物对应的水化物可与其气态氢化物发生化合反应
D. 四种元素各自形成的单质中,W元素形成的单质沸点最低
难度: 中等查看答案及解析
-
将1gH2和4gO2混合点燃,充分反应,放出71.45kJ热量,同样条件下1molH2在O2中完全燃烧放出的热量是
A.71.45kJ B.142.9kJ C.571.6kJ D.285.8kJ
难度: 简单查看答案及解析
-
在体积一定的密闭容器中进行如下反应:X2(g)+2Y2(g)
2Z(g),已知X2、Y2、Z的起始浓度分别为a mol/L、b mol/L、 0.2mol/L(非平衡态),在一定条件下,当反应达到平衡时,Z的浓度为 0.3mol/L,则下列判断正确的是( )
A. b≥0.1mol/L
B. 改变条件建立新平衡时Z的平衡浓度c:0.2mol/L≤c<0.3mol/L
C. a≥0.05 mol/L
D. 该平衡时气体物质的量浓度之和小于(a+b+0.2)mol/L
难度: 简单查看答案及解析
-
短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13。X与Y、Z位于相邻周期, Z原子最外层电子数是X原子内层电子数的3倍或者Y原子最外层电子数的3倍。下列说法正确的是
A. X的氢化物溶于水显酸性
B. Y的氧化物是离子化合物
C. Z的氢化物的水溶液在空气中存放不易变质
D. X和Z的最高价氧化物对应的水化物都是弱酸
难度: 中等查看答案及解析
-
在一定条件下,测得2CO2
2CO+O2(反应从CO2开始)平衡体系的平均相对分子质量为M,在此条件下,CO2的分解率为( )
A.
B.
C.
D.
难度: 简单查看答案及解析
