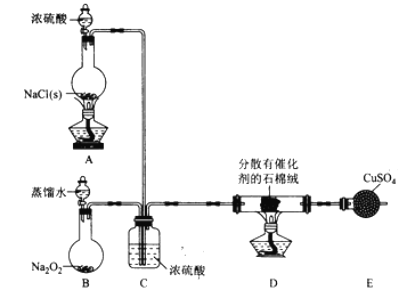
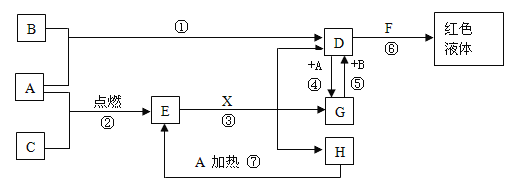
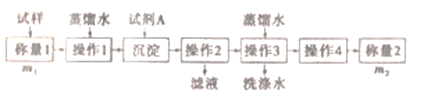
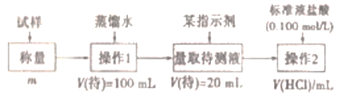
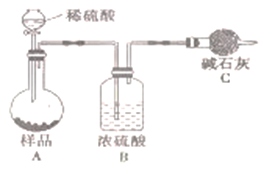
-
C和CuO在一定温度下反应,产物有Cu、Cu2O、CO、CO2。若将2.00 g C跟16.0 g CuO混合,隔绝空气加热,将生成的气体全部通过足量的澄清石灰水,反应一段时间后共收集到1.12 L气体(标准状况),生成沉淀的质量为5.00 g。下列说法错误的是
A. 反应后的固体混合物中还含有碳
B. 反应后的固体混合物中氧化物的物质的量为0.05 mol
C. 反应后的固体混合物中Cu的质量为12.8 g
D. 反应后的固体混合物总质量为14.4 g
难度: 中等查看答案及解析
-
在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是
A. 氯水的颜色呈浅绿色,说明氯水中含有Cl2
B. 向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl-
C. 向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+
D. 向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO
难度: 中等查看答案及解析
-
下列关于碱金属元素和卤素的说法中,错误的是
A. 卤族元素的氢化物稳定性从上到下逐渐减弱
B. 卤素的单质其熔沸点从上到下逐渐增大
C. 碱金属元素的最高价氧化物对应的水化物的碱性从上到下逐渐增强
D. 碱金属元素单质的密度从上到下逐渐升高
难度: 中等查看答案及解析
-
下列有关物质的工业用途不正确的是
A. 钠:制备过氧化钠、氯化钠等
B. 铝:制导线:用作冶炼锰、钨的原料
C. 碳酸氢钠:制发酵粉、治疗胃酸过多的胃药
D. 碳酸钠:制玻璃、制肥皂、制烧碱、造纸、纺织
难度: 简单查看答案及解析
-
甲、乙为单质, 丙、丁为氧化物, 它们存在如图反应(反应条件省略)。下列各组的甲、乙
一定不符合的是

A. 铝和铁 B. 氟和氧 C. 碳和硅 D. 镁和碳\
难度: 中等查看答案及解析
-
若用X代表F、Cl、Br、I四种卤族元素,下列能够表达它们的共性反应的是 ( )
A. X2+H2O═HX+HXO B. 2Fe+3X2═2FeX3
C. X2+H2═2HX D. X2+2NaOH═NaX+NaXO+H2O
难度: 中等查看答案及解析
-
下列实验操作能达到实验目的的是
A. 加热使I2升华,可除去铁粉中的I2
B. 电解熔融的氯化铝,可制备铝单质
C. 加入足量氨水,充分振荡、过滤,可除去硫酸铜溶液中的硫酸铝杂质
D. 将饱和FeCl3溶液逐滴加到沸水中继续煮沸至液体呈红褐色,可制备Fe(OH)3胶体
难度: 中等查看答案及解析
-
氟氧酸是较新颖的氧化剂,应用性极强,可用被氮气稀释的氟气在细冰上缓慢通过制得:F2+H2O═HOF+HF。该反应中水的作用与下列反应中水的作用相同的是
A. 氟单质与水反应制氧气 B. 钠与水反应制氢气
C. 氯气与水反应制次氯酸 D. 过氧化钠与水反应制氧气
难度: 中等查看答案及解析
-
下列有关文献记载中涉及的化学知识表述不正确的是
A. “以曾青涂铁,铁赤色如铜”说明我国古代就掌握了“湿法冶金”技术
B. “墙塌压糖,去土而糖白”中的脱色过程发生了化学变化
C. “丹砂烧之成水银,积变又还成丹砂”讲的是单质与化合物之间的互变
D. “煤饼烧蛎房成灰(蛎房即牡蛎壳)”中灰的主要成分为氧化钙
难度: 简单查看答案及解析
-
下列除杂方案错误的是
选项
被提纯的物质
杂质
除杂试剂
除杂方法
A
CO(g)
CO2(g)
NaOH 溶液、浓 H2SO4
洗气
B
NH4Cl(aq)
Fe3+(aq)
NaOH溶液
过滤
C
Cl2(g)
HCl(g)
饱和食盐水、浓H2SO4
洗气
D
Na2CO3(s)
NaHCO3(s)
—
灼烧
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程,下列有关说法正确的是
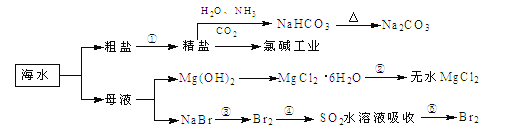
A. 制取NaHCO3的反应是利用其溶解度小于NaCl和NH4Cl
B. ①粗盐提纯中除去杂质离子Mg2+、Ca2+、SO42-时,必须先除Ca2+后除SO42-
C. 在工段③、④、⑤中,溴元素均被氧化
D. 工业上通过电解饱和MgCl2溶液制取金属镁
难度: 中等查看答案及解析
-
碳酸铜和碱式碳酸铜均可溶于盐酸转化为氯化铜。高温下这两种化合物均能分解成氧化铜。溶解28.4g上述混合物,消耗1mol/L盐酸500mL.灼烧等质量的上述混合物,得到氧化铜的质量是
A. 35g B. 30g C. 20g D. 15g
难度: 中等查看答案及解析
-
下列说法不正确的是
A. 向Na2CO3溶液中逐滴加入HCl,直到不再生成CO2气体为止,在此过程中,溶液中的HCO3-浓度变化是先变大后变小(溶液体积变化均忽略不计)
B. 向NaHCO3溶液中加入Ba(OH)2固体,CO32-的浓度变化先变大后变小(溶液体积变化均忽略不计)
C. 有含0.2 mol Na2CO3和含0.3 mol HCl的两种溶液:①将Na2CO3溶液逐滴滴入HCl溶液中;②将HCl溶液逐滴滴入Na2CO3溶液中;①②两种操作生成的CO2体积之比为3∶2
D. 将等质量的Na2O和Na2O2样品分别放入等量的水中,所得溶液的质量分数分别为a%和b%,则a、b的关系是:a=b
难度: 简单查看答案及解析
-
下列实验对应的现象及结论均正确且两者具有因果关系的是
选项
实验
现象
结论
A.
向足量含淀粉的FeI2溶液中滴加2滴氯水
溶液变蓝
还原性:I―>Fe2+
B.
白铁皮(镀锌铁)出现刮痕后浸泡在饱和食盐水中,一段时间后滴入几滴K3[Fe(CN)6]溶液
无明显现象
该过程未发生原电池反应
C.
向FeCl2溶液中加入足量Na2O2粉末
出现红褐色沉淀和无色气体
FeCl2溶液部分变质
D.
SO2通入BaCl2溶液,然后滴入稀硝酸
白色沉淀,白色沉淀不溶于稀硝酸
所得沉淀为BaSO3,后转化为BaSO4
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
用下列实验装置进行相应实验,装置正确且能达到实验目的的是
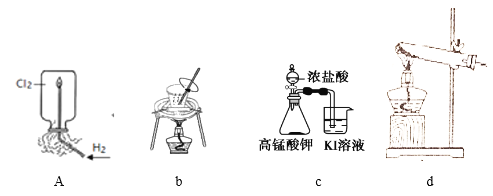
A. 用图a所示装置验证H2在Cl2中燃烧的实验现象
B. 用图b所示装置从饱和食盐水中提取氯化钠
C. 用图c所示装置探究氧化性:KMnO4>Cl2>I2
D. 用图d所示装置分解MgCl2·6H2O获取MgCl2
难度: 中等查看答案及解析
-
.某同学利用下列实验探究金属铝与铜盐溶液反应:

下列说法正确的是
A. 由实验1可以得出结论:金属铝的活泼性弱于金属铜
B. 溶液中阴离子种类不同是导致实验1、2出现不同现象的原因
C. 实验2中生成红色物质的离子方程式:Al+Cu2+→Al3++Cu
D. 由上述实验可推知:用砂纸打磨后的铝片分别与c(H+)均为0.2 mol/L的盐酸和硫酸反应,后者更剧烈
难度: 中等查看答案及解析
-
为了探究金属单质M与盐溶液的反应,某同学进行了下列实验,实验过程及现象如图所示,结合实验现象判断,该同学得出的下列结论中正确的是

A. 向滤液中滴加盐酸的实验现象是产生白色沉淀
B. 滤渣可能是两种单质的混合物
C. 滤渣在足量的稀硝酸中能完全溶解
D. 加入的金属M可能是镁或钠
难度: 困难查看答案及解析
-
用4种溶液进行实验,下表中“溶液”与“操作及现象”对应关系错误的是 ( )
选项
溶液
操作及现象
A.
Ca(OH)2溶液
通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失,再加入足量NaOH溶液,又变浑浊
B.
NaAlO2溶液
通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失
C.
Ca(ClO)2溶液
通入CO2,溶液变浑浊,再加入品红溶液,红色褪去
D.
CaCl2溶液
通入CO2,溶液没有明显变化,再通入氨气,溶液变浑浊
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
向含1mol HCl和1mol MgSO4的混合溶液中加入1mol·L—1的Ba(OH)2溶液,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)间的关系图正确的是( )

难度: 简单查看答案及解析
-
向某NaOH溶液中通入CO2气体后得到溶液M,因CO2通入的量不同,溶液M的组成也不同,若向溶液M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如图所示。则下列分析与判断不正确的是(不计CO2溶解)

A. 若OB=0,则形成溶液的过程中所发生反应的离子方程式为OH―+CO2═HCO3―
B. 若OB=BC,则溶液M为Na2CO3溶液
C. 若OB>BC,则溶液M中大量存在的阴离子为CO32―和HCO3―
D. 若3OB=BC,则溶液M中c(NaHCO3)=2c(Na2CO3)
难度: 中等查看答案及解析
-
下列离子方程式与所述事实相符且正确的是
A. 磁性氧化铁溶于稀硝酸:Fe3O4+8H++NO3-=3Fe3++NO↑+4H2O
B. Mg(HCO3)2 溶液中加入足量 NaOH 溶液:Mg2++2HCO3-+2OH-=MgCO3↓+CO32-+2H2O
C. 向含有 0.2 mol FeI2 的溶液中通入 0.1 mol Cl2 充分反应:2I-+Cl2=2Cl-+I2
D. 明矾溶液中加入 Ba(OH)2 溶液至生成沉淀的物质的量最多:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O
难度: 中等查看答案及解析
-
下列离子方程式书写不正确的是
A. AlCl3溶液与烧碱溶液反应,当n(OH-)∶n(Al3+)=7∶2时,2Al3++7OH―═Al(OH)3↓+AlO2―+2H2O
B. 向饱和Na2CO3溶液中通入过量CO2,CO32―+CO2+H2O═2HCO3―
C. CuCl2溶液与NaHS溶液反应,当n(CuCl2)∶n(NaHS)=1∶2时,Cu2++2HS―═CuS↓+H2S↑
D. Fe与稀硝酸反应,当n(Fe)∶n(HNO3)=1∶2时,3Fe+2NO3―+8H+═3Fe2++2NO↑+4H2O
难度: 中等查看答案及解析
-
已知NH4CuSO3与足量的1mol/L硫酸溶液混合微热,产生下列现象:
①有红色金属生成;
②有刺激性气味气体产生;
③溶液呈蓝色。据此判断下列说法合理的是
A. NH4CuSO3中硫元素被氧化 B. 刺激性气味的气体是二氧化硫
C. 刺激性气味的气体是氨气 D. 该反应中硫酸作氧化剂
难度: 中等查看答案及解析
-
某无色气体,可能含HCl、CO2、NO2、HI、SO2、HBr中的一种或几种。将其通入氯水中,得到无色透明溶液,把溶液分成两份,向一份中加入盐酸酸化的BaCl2溶液,出现白色沉淀,另一份加入硝酸酸化的AgNO3溶液,也有白色沉淀生成。对于原无色气体推断一定正确的是
A. 一定存在HCl B. 一定存在SO2 C. 肯定没有CO2 D. 不能肯定是否含有NO2、HI
难度: 中等查看答案及解析
-
下列叙述正确的是
A. 等量的氯气分别与足量氢氧化钠和硫化钠充分反应,转移的电子数相同
B. 等量的铜分别与足量浓、稀硝酸充分反应,生成气体的物质的量相同
C. 等量的铝分别与氢氧化钠溶液和盐酸充分反应,生成气体体积一定相同
D. 等量的铁分别与足量氯气和硫充分反应,生成物质的物质的量相同
难度: 中等查看答案及解析
-
下列说法中正确的有
①分解高锰酸钾制氧气后,残留在试管内壁上的黑色物质可用稀盐酸洗涤
②已知潮湿的SO2和Cl2反应生成两种无漂白性的酸,故二者混合一定不能使有色布条褪色
③蒸干BeCl2溶液可得纯净的无水氯化铍
④Fe3O4可写成FeO·Fe2O3。已知铅与碳同族,则Pb3O4也可写成PbO·Pb2O3
⑤因为氯气沸点高,易液化,所以氯水可以保存在钢瓶中
⑥用米汤直接检验食用盐中是否含有碘元素
⑦Na2O2既可作呼吸面具中供氧剂,又可漂白织物、麦杆、羽毛等
A. 3个 B. 2个 C. 1个 D. 0个
难度: 中等查看答案及解析
-
下列有关物质的应用与性质相对应的说法正确的有几个 ( )
①明矾能用于净水是因为铝离子水解生成的氢氧化铝胶体具有强氧化性
②氯化铁溶液可用于制作印刷电路板是因为其能氧化单质铜
③浓硫酸可用作干燥剂是因为其具有脱水性
④光导纤维可用作通讯材料是因为其具有导电性
⑤MgO、Al2O3的熔点很高,可制作耐高温材料
⑧NaHCO3能与碱反应,因此食品工业上用作焙制糕点的膨松剂
⑦铝制餐具不宜用来蒸煮或长时间存放酸性、碱性或咸的食物
A. 2个 B. 3个 C. 4个 D. 5个
难度: 中等查看答案及解析
-
将一定量的铜粉加入到100 mL某浓度的稀硝酸中充分反应后,容器中剩有m1 g铜粉,此时共收集到NO气体448 mL(标准状况),然后向上述混合物中加入足量稀硫酸至不再反应为止,容器剩有铜粉m2 g,则(m1-m2)为
A. 5.76 B. 2.88 C. 1.92 D. 0.28
难度: 中等查看答案及解析
-
已知:将Cl2通入适量NaOH溶液,产物中可能有NaCl、NaClO、 NaClO3,且
的值与温度高低有关。当n(NaOH)=a mol时,下列有关说法错误的是
A. 参加反应的氯气的物质的量等于a/2 mol
B. 改变温度,产物中NaClO3的最大理论产量为a/7 mol
C. 改变温度, 反应中转移电子的物质的量ne的范围:a/2 mol≤ne≤5a/6 mol
D. 若某温度下,反应后
=11,则溶液中
难度: 中等查看答案及解析
-
2.8 g铁全部溶于一定浓度、200 mL的HNO3溶液中,得到标准状况下的气体1.12 L,测得反应后溶液的pH为1,若反应前后溶液体积变化忽略不计,则下列有关判断正确的是
A. 反应后的溶液最多还能溶解1.4 g Fe
B. 1.12 L气体可能是NO、NO2的混合气体
C. 反应后溶液中铁元素可能以Fe2+形式存在
D. 反应后溶液中c(NO3-)=0.85 mol/L
难度: 中等查看答案及解析