-
某温度下,将1.1mol I2加入到氢氧化钾溶液中,反应后得到 KI、KIO、KIO3的混合液。经测定IO-与IO3-的物质的量之比是2:3.下列说法错误的是
A. I2在该反应中既作氧化剂又做还原剂
B. I2的还原性大于KI的还原性,小于KIO和KIO3的还原性
C. 该反应中转移电子的物质的量为1.7mol
D. 该反应中,被还原的碘元素与被氧化的碘元素的物质的量之比是17:5
难度: 中等查看答案及解析
-
化学与社会、生活密切相关。对下列现象或事实的解释不正确的是( )
选项
现象或事实
解释
A
春节期间全国各地燃放的烟火
某些金属元素焰色反应所呈现出来色彩
B
Na2O2用于呼吸面具中作为O2的来源
Na2O2是强氧化剂,能氧化CO2、H2O生成O2
C
K2FeO4用于自来水的消毒和净化
K2FeO4具有强氧化性,被还原后生成的
Fe3+水解生成胶状物,可以净化水
D
Al(OH)3用作医用的胃酸中和剂
Al(OH)3的碱性不强,但却可以与胃酸反应
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列说法中正确的是( )
A. 能电离出离子的化合物都是离子化合物
B. 熔融状态下能导电的化合物一定是离子化合物
C. 不同元素组成的多原子分子里的化学键一定是极性键
D. 非金属元素构成的单质中一定存在共价键
难度: 简单查看答案及解析
-
(题文)有关下列有机物的说法中错误的是
A. 石油经分馏后再通过裂化和裂解得到汽油
B. 植物油通过氢化加成可以变成脂肪
C. 用灼烧的方法可以区别蚕丝和合成纤维
D. 在做淀粉的水解实验时,用碘水检验淀粉是否完全水解
难度: 简单查看答案及解析
-
下列离子在指定溶液中一定不能大量共存的是( )
A. 弱碱性溶液中:HCO3-、NO3-、Na+、Cl-
B. 常温时pH=7的溶液中:Fe3+、SO42-、K+、Cl-
C. 含NO3-的溶液中:Fe3+、SO42-、H+、NH4+
D. 与铝反应产生H2的溶液中:S2-、K+、CO32-、Na+
难度: 中等查看答案及解析
-
NA代表阿伏加德罗常数的数值,下列说法中错误的是( )
A. 完全燃烧1.5 mol乙醇和乙烯的混合物,转移电子数为18 NA
B. 7.8 g由Na2S和Na2O2组成的混合物中含有阴离子的数目为0.1 NA
C. 0.1 mol/L FeCl3溶液中Fe3+的物质的量一定小于0.1 NA
D. 常温常压下,60g甲醛和乙酸的混合物所含碳原子数为2 NA
难度: 中等查看答案及解析
-
提纯下列物质(括号内为少量杂质),所选用的除杂试剂与分离方法错误的是( )
不纯物质
除杂试剂
分离方法
A
Mg(Al)
NaOH溶液
过滤
B
乙烷(乙烯)
溴水
洗气
C
CuCl2(FeCl3)
单质铜
过滤
D
乙酸乙酯(乙酸)
饱和碳酸钠溶液
分液
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列试剂的保存方法及解释中错误的是( )
A. 金属钾在空气中易被氧化,钾的密度比煤油大,钾不与煤油反应,因此少量钾保存在煤油中
B. NaOH与玻璃中的SiO2反应,因此NaOH溶液保存在配有橡胶塞的细口瓶中
C. 常温时铝遇浓硫酸钝化,所以可以用铝制容盛装浓硫酸
D. 为防止FeSO4水解而变质,常在溶液中加入少量铁粉
难度: 简单查看答案及解析
-
(题文)甲、乙为两种常见的单质,丙、丁为氧化物,它们存在如下转化关系,则不满足条件的甲和乙为
A. 铝和铁 B. 镁和碳 C. 铁和氢气 D. 铜和氢气
难度: 简单查看答案及解析
-
下列离子方程式书写不正确的是 ( )
A. 等体积、等物质的量浓度的NaHCO3和Ca(OH)2两溶液混合:HCO3-+Ca2++OH-=CaCO3↓+H2O
B. 向澄清石灰水中通入过量的CO2:OH-+CO2=HCO3-
C. 在含3a mol HNO3的稀溶液中,加入a mol 铁粉:4Fe+12H+ +3NO3-=Fe3++3Fe2++3NO↑+6H2O
D. Al2(SO4)溶液中加入过量氨水:Al3++4NH3•H2O=AlO2-+4NH4++2H2O
难度: 中等查看答案及解析
-
向含Al2(SO4)3和AlCl3的混合溶液中逐滴加入1mol/LBa(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所得沉淀的物质的量的关系如图,下列说法不正确的是
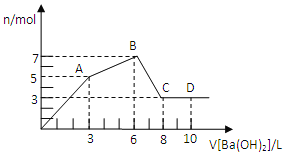
A. 原混合液中c(SO42-):c(Cl-)=1:1
B. 向D点溶液中通入C02气体,立即产生白色沉淀
C. 图中A点沉淀中含有BaSO4和Al(OH)3
D. AB段反应的离子方程式为:Al3++3OH-=Al(OH)3↓
难度: 困难查看答案及解析
-
利用Cu和浓硫酸制备SO2的反应涉及的装置,下列说法正确的是
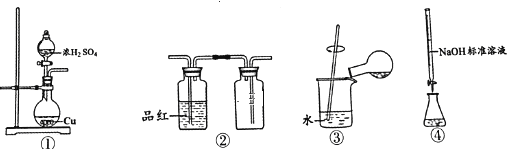
A. 用装置①制备SO2 B. 用装置②检验和收集SO2
C. 用装置③稀释反应后溶液 D. 用装置④测定反应后溶液中c(H+)
难度: 简单查看答案及解析
-
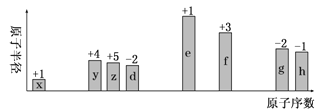
W、X、Y、Z是原子序数依次增大的四种短周期元素,分属于连续的四个主族,电子层数之和为10,四种原子中X原子的半径最大,下列说法不正确的是
A. Y原子形成的离子是同周期元素所形成的离子中半径最小的
B. Y的最高价氧化物不能与Z的最高价氧化物对应的水化物反应
C. W与同主族元素可以形成离子化合物
D. 工业上获得X单质可利用电解其熔融的氧化物的方法
难度: 简单查看答案及解析
-
对于反应2SO2(g)+O2(g)
2SO3(g)△H<0。达到平衡后,以下分析正确的是
A. 减小生成物浓度,对正反应的反应速率影响更大
B. 扩大容器体积,对正反应的反应速率影响更大
C. 降低温度,对正反应的反应速率影响更大
D. 加入催化剂,对逆反应的反应速率影响更大
难度: 简单查看答案及解析
-
如图装置(Ⅰ)为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池放电、充电的化学方程式为2K2S2+KI3
K2S4 +3KI。装置(Ⅱ)为电解池的示意图,当闭合开关K时,电极X附近溶液先变红。则闭合K时,下列说法不正确的是( )
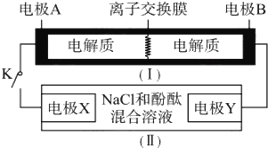
A. K+从左到右通过离子交换膜 B. 电极A上发生的反应为I3-+2e-=3I-
C. 电极Y上发生的反应为2Cl--2e-=Cl2↑ D. 当有0.1 molK+通过离子交换膜,X电极上产生1.12L气体(标准状况)
难度: 中等查看答案及解析
-
室温下,将0.1mol/L的一元酸HA溶液逐滴滴加到10mL0.1mol/LNaOH溶液中,pH的变化曲线如图所示。下列说法错误的是

A. a点所示溶液中c(Na+)>c(A-)>c(OH-)>c(HA)
B. a、b两点所示溶液中水的电离程度a点大于b点
C. pH=7时,c(Na+)=c(A-)+c(HA)
D. 一元酸HA为弱酸
难度: 困难查看答案及解析
-
将一定量的镁和铜组成的混合物加入到过量的稀硝酸中,金属完全溶解(假设反应中还原产物只有NO)。向反应后的溶液中加入3mol/L NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g。则下列叙述中错误的是
A. 当生成的沉淀量达到最大时,消耗NaOH溶液的体积V=100ml
B. 当金属全部溶解时,参加反应的硝酸的物质的量一定是0.4mol
C. 参加反应的金属的总质量为9.6g>m>3.6g
D. 当金属全部溶解时收集到NO气体的体积在标准状况下一定为2.24L
难度: 困难查看答案及解析
-
从海水中提取镁的工业流程如下图所示,下列说法正确的是
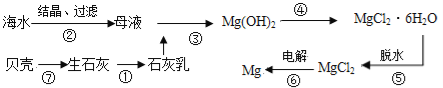
A. 在实验室进行②的操作需用到坩埚、坩埚钳、玻璃棒、酒精灯
B. 步骤⑥电解MgCl2时,阴极产生H2
C. 步骤⑤应将晶体置于HCl气体氛围中脱水
D. 上述工艺流程中的反应未涉及氧化还原反应
难度: 中等查看答案及解析
-
将一定量纯净的氨基甲酸铵置于密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:H2NCOONH4(s)
2NH3(g)+CO2(g)。能判断该反应已经达到化学平衡的是( )
①v(NH3)正=2v(CO2)逆 ②密闭容器中总压强不变 ③密闭容器中混合气体的密度不变 ④密闭容器中混合气体的平均相对分子质量不变 ⑤密闭容器混合气体的总物质的量不变⑥密闭容器中CO2的体积分数不变 ⑦ 混合气体总质量
A. ①②③⑤⑦ B. ①②⑤⑦ C. ①⑤⑥ D. 全部
难度: 中等查看答案及解析
-
某烃的含氧衍生物的相对分子质量为102,其中氧元素的质量分数约为31.4%,则能与NaOH溶液反应的有机物有(不含立体异构)( )
A. 11种 B. 8种 C. 12种 D. 13种
难度: 中等查看答案及解析