-
在塑料袋中放一个成熟的苹果和一些青香蕉,将袋口密封,两天后青香蕉成熟了。导致青香蕉成熟的物质是成熟苹果释放出的
A. C2H4 B. CH3COOH C. C6H6 D. CH3CH2OH
难度: 简单查看答案及解析
-
铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体积相等时,反应中消耗的HCl和NaOH物质的量之比为 ( )
A. 1:1 B. 2:1 C. 3:1 D. 1:3
难度: 中等查看答案及解析
-
下列叙述不正确的是
A. NH3易液化,液氨常用作制冷剂
B. 浓HNO3的氧化性强于稀HNO3
C. 氨盐受热易分解,因此贮存氨态氮肥时要密封保存,并放在阴凉通风处
D. 稀HNO3和活泼金属反应时主要得到氢气
难度: 中等查看答案及解析
-
下列图示的设备能将化学能转化为电能的是 ( )

A

B
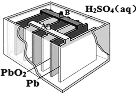
C

D
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列说法正确的是
A. 煤和石油都是可再生资源 B. 分离煤焦油可以获取苯
C. 石油的裂化仅能得到烷烃 D. 煤的气化和石油的分馏都属于物理变化
难度: 简单查看答案及解析
-
下列反应中生成物总能量高于反应物总能量的是 ( )
A. Ba(OH)2·8H2O与NH4Cl反应 B. 乙醇燃烧
C. 铝粉与氧化铁粉末反应 D. NaOH溶液与盐酸反应
难度: 简单查看答案及解析
-
将氨气通过灼热的CuO后,发现固体变红色,此外还收集到一种单质气体,这种气体估计应是( )
A. O2 B. H2 C. NO D. N2
难度: 简单查看答案及解析
-
在铝与稀硫酸的反应中,已知10s末硫酸的浓度减少了0.6mol·L-1,若不考虑反应过程中溶液体积的变化,则10s内生成硫酸铝的平均反应速率是 ( )
A. 1.2mol·L-1·min-1 B. 1.8mol·L-1·min-1
C. 0.02mol·L-1·min-1 D. 0.18mol·L-1·min-1
难度: 中等查看答案及解析
-
将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中,以下叙述正确的是 ( )
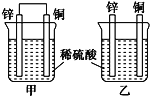
A. 两烧杯中铜片表面均无气泡产生
B. 甲中铜片是正极,乙中铜片是负极
C. 两烧杯中溶液的pH均增大
D. 产生气泡的速率甲比乙慢
难度: 中等查看答案及解析
-
用指定材料做电极来电解一定浓度的溶液甲,然后加入物质乙能使溶液恢复为甲溶液原来的浓度,则合适的组是:
阳极
阴极
溶液甲
物质乙
A.
Pt
Pt
NaOH
NaOH固体
B.
Pt
Pt
H2SO4
H2O
C.
C
Fe
NaCl
盐酸
D.
粗铜
精铜
CuSO4
Cu(OH)2
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是
A. Cu(OH)2与稀硝酸反应:H++OH-=H2O
B. 铜片与浓硝酸反应:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O
C. 铁与稀硝酸反应:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O
D. 浓烧碱溶液中加入铝片:2Al + 4OH-= 2AlO2- + 2 H2↑
难度: 中等查看答案及解析
-
下列各组物质的相互关系描述正确的是 ( )
A. H2、D2和T2互为同位素
B. 金刚石、C60、石墨互为同系物
C. (CH3)2CHC2H5和CH3CH2CH(CH3)2属于同种物质
D.
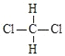 和
和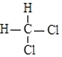 互为同分异构体
互为同分异构体难度: 简单查看答案及解析
-
可以用分液漏斗分离的一组化合物是 ( )
A. 硝基苯和水 B. 苯和溴苯 C. 酒精和乙醚 D. 溴乙烷和汽油
难度: 中等查看答案及解析
-
下列有机反应属于加成反应的是 ( )
A. CH4+Cl2
CH3Cl+HCl B. CH2=CH2+HBr→CH3CH2Br
C.
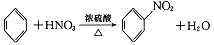 D.
D. 难度: 简单查看答案及解析
-
如图是四种常见有机物的比例模型示意图。下列说法正确的是( )
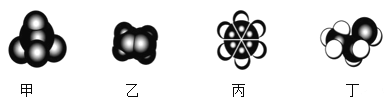
A. 甲能使酸性KMnO4溶液褪色
B. 乙可与溴水发生取代反应而使溴水褪色
C. 丙中的碳碳键是介于碳碳单键和碳碳双键之间的独特键
D. 丁与浓硫酸混合加热,只能发生消去反应生成乙烯
难度: 简单查看答案及解析
-
有一种新合成的烃称为立方烷,它的碳架结构如图所示,关于它的说法不正确的是
A. 分子式是C8H8
B. 与苯乙烯(
)互为同分异构体
C. 不能发生加成反应
D. 二氯取代物共有4种
难度: 中等查看答案及解析
-
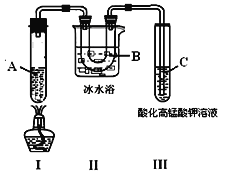
下列实验装置或操不能达到实验目的的是( )
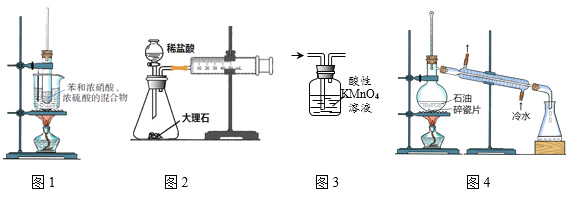
A. 图1可用于实验室制取硝基苯
B. 图2可用于测定CO2的生成速率
C. 图3可用于除去甲烷中少量的乙烯得纯净甲烷
D. 图4可用于石油的蒸馏
难度: 中等查看答案及解析
-
C2H5OH、CH4、C3H8、C是常用的燃料,它们的燃烧热依次为1366.8kJ·mol-1、890.3kJ·mol-1、2219.9kJ·mol-1、393.5kJ·mol-1。相同质量的这四种燃料,完全燃烧时放出热量最少的是 ( )
A. C2H5OH B. CH4 C. C3H8 D. C
难度: 简单查看答案及解析
-
已知拆开1mol氢气中化学键需要吸收436kJ热量,拆开1mol氧气中的化学键需要吸收496kJ的热量,形成1molH—O共价键放出463kJ的热量。反应2H2(g)+O2(g)=2H2O(g)的能量变化如图所示。下列说法正确的是 ( )
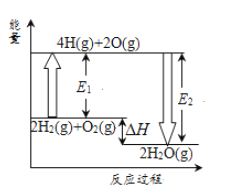
A. 2H(g)→H2(g)
H>0
B. 图中E1=932kJ
C. 图中E2=926kJ
D. 2H2(g)+O2(g)=2H2O(g)
H=-484kJ·mol-1
难度: 中等查看答案及解析
-
灰锡(以粉末状存在)和白锡是锡的两种同素异形体。已知:
①Sn (s、白)+2HCl (aq)=SnCl2 (aq)+H2 (g);DH1
②Sn (s、灰)+2HCl (aq)=SnCl2 (aq)+H2 (g);DH2
③Sn (s、灰)
Sn (s、白);DH3=+2.1 kJ/mol
下列说法正确的是( )
A. DH1>DH2
B. 锡在常温下以灰锡状态存在
C. 灰锡转化为白锡的反应是放热反应
D. 锡制器皿长期处于低于13.2 ℃的环境中,会自行毁坏
难度: 中等查看答案及解析
-
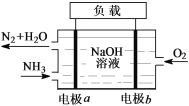
下图是氢氧燃料电池驱动LED发光的装置,其电极反应式为:2H2+4OH--4e-=4H2O,O2+2H2O+4e-=4OH-。下列有关叙述正确的是( )
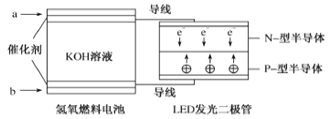
A. H2在负极发生氧化反应 B. 该装置中只涉及两种形式的能量转化
C. 氢氧燃料电池中OH-向b极移动 D. P-型半导体连接电池的负极
难度: 中等查看答案及解析
-
在气体反应中,能使反应物中活化分子数和活化分子百分数同时增大的方法是 ( )
①增大反应物的浓度 ②升高温度 ③增大压强 ④移去生成物 ⑤加入催化剂
A. ①③⑤ B. ②⑤ C. ②③⑤ D. ①③④
难度: 简单查看答案及解析
-
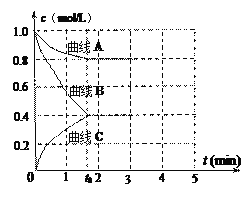
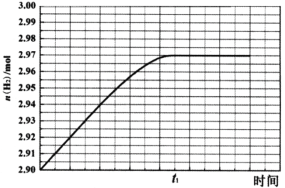
CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如右图所示。下列结论不正确的是( )
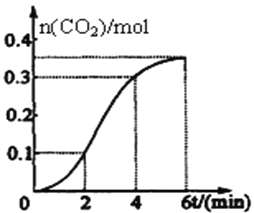
A. 反应开始2分钟内平均反应速率最大
B. 反应4分钟后平均反应速率最小
C. 反应开始4分钟内温度对反应速率的影响比浓度大
D. 反应4分钟后反应速率下降的原因是盐酸浓度逐渐减小
难度: 简单查看答案及解析
-
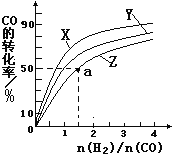
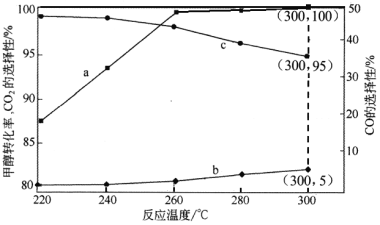
已知CO和H2在一定条件下合成甲醇的反应为:CO(g)+2H2(g)
CH30H(g),现在容积均为l L的a、b、c三个密闭容器中分别充入l molCO和2mol H2的混合气体,控制温度,进行反应,测得相关数据的关系如图l和图2所示。下列说法正确的是( )
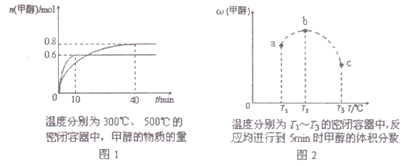
A. 该反应的正反应的△H>0
B. 升温或减压,可将b中的平衡状态转变成从c中的平衡状态
C. 反应进行到5min时,a容器中v(正)= v(逆)
D. 达到平衡时,a、b、c中CO转化率为b>a>c
难度: 困难查看答案及解析
-
一种生产聚苯乙烯的流程如下:
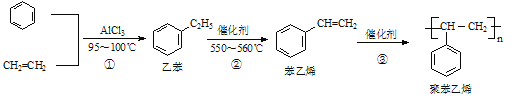
下列叙述不正确的是
A. 苯乙烯的分子式为C8H8
B. 1mol苯乙烯最多可与4molH2发生加成反应
C. 鉴别乙苯与苯乙烯可用Br2的四氯化碳溶液
D. 乙烯、苯和乙苯的分子中所有原子均可处于同一平面
难度: 简单查看答案及解析