-
NH3是一种重要的化工原料,在生产、生活中用途广泛。
(1)已知:
| 共价键 | H―H | N≡N | N―H |
| 键能/ kJ·mol-1 | 436 | 946 | 391 |
注:拆开气态物质中1 mol某种共价键需要吸收的能量,就是该共价键的键能。
N2 (g)+3 H2 (g) 2 NH3 (g) H =_____kJ·mol-1
2 NH3 (g) H =_____kJ·mol-1
(2)一定温度下,向恒容的密闭容器中充入N2和H2发生反应:N2+3H2 2NH3,测得各组分浓度随时间变化如图8所示。
2NH3,测得各组分浓度随时间变化如图8所示。
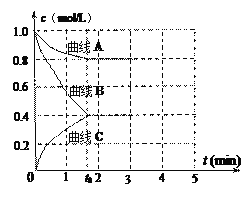
①表示c(N2)的曲线是__________(填“曲线A”、“曲线B”或“曲线C”)。
② 0~t0时用H2表示的反应速率:v(H2)=___________________mol·L-1·min-1。
③ 下列能说明该反应达到平衡的是________。
a.混合气体的压强不再变化
b.2c(H2)= 3c(NH3)
c.混合气体的质量不再变化
d.NH3的体积分数不再变化
(3)潜艇中使用的液氨-液氧燃料电池工作原理如图所示:
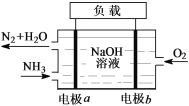
① 电极b名称是__________。
② 电解质溶液中OH-离子向________移动(填“电极a”或“电极b”)。
③电极a的电极反应式为______________________。
(4)可通过NH3与NaClO反应来制得火箭燃料肼(N2H4)。该反应的化学反应方程式是___________________________________________。
-
氨、硫、氯及其化合物对环境有着重要的影响,在化工生产和日常生活中的用途也十分广泛,如用做漂白剂、沉淀剂、农药、化肥等。
(1)以N2 和H2 为原料合成氢气为: N2(g) + 3 H2(g)  2NH3(g) △H=Q kJ•mol—1。已知键键能为946 kJ•mol—1 ,H-H键键能为436kJ• mol—1,N-H键键能为391kJ• mol—1,则Q=_______。
2NH3(g) △H=Q kJ•mol—1。已知键键能为946 kJ•mol—1 ,H-H键键能为436kJ• mol—1,N-H键键能为391kJ• mol—1,则Q=_______。
(2)将体积均为560 mL(标准状况下)的SO2 和Cl2 同时缓慢通A水中,得到1.0 L溶液,则溶液pH=_______。
(3)物质的量浓度相等的NH4HSO3溶液和NaHSO3 溶液中,阴离子的电离程度较小的是__________(填化学式),原因是___________ 。
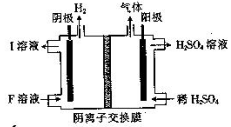
(4)用惰性电极电解NaHSO3 溶液的装置如图所示,则I是___________(填化学式,下同),阳极区放出的混合气体的成分为___________。
(5)氨水是一种常见的沉淀剂。向1.0 L 2.0×10—4mol•L—1的MgCl2 溶液中通入(不考虑溶液体积的变化),有白色沉淀生成。
①写出生成白色沉淀的离子方程式____________________.
②当反应中开始有白色沉淀出现时,通人的体积(标准状况)为___________mL。
(已知实验条件下NH3.H2O的电离平衡常数为1.8×l0—5,Ksp=[Mg(OH)2]=1.8×l0—11)
-
天然气既是高效洁净的能源,又是重要的化工原料,在生产、生活中用途广泛。
(1)已知25℃、101kPa时,1g甲烷不完全燃烧生成CO和液态水时放出37.96kJ热量,则该条件下反应2CH4(g)+3O2(g)=2CO(g)+4H2O(l)的ΔH=___kJ·mol-1。
(2)甲烷可以消除氮氧化物污染。如:CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g)。下列措施能够使该反应速率加快的是___。
N2(g)+CO2(g)+2H2O(g)。下列措施能够使该反应速率加快的是___。
a.使用催化剂 b.降低温度 c.及时分离水
(3)甲烷可直接应用于燃料电池,该电池采用可传导O2-的固体氧化物为电解质,其工作原理如图所示:
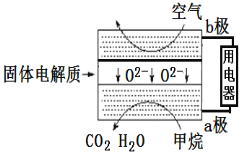
①外电路电子移动方向:___。(填“a极到b极”或“b极到a极”)。
②a极电极反应式为___。
③若燃料电池消耗的空气在标准状况下的体积是22.4L(假设空气中O2体积分数为20%),则理论上消耗甲烷___mol。
-
氨气在生产、生活和科研中应用十分广泛。
(1)以CO2与NH3为原料合成尿素的主要反应如下:
2NH3(g)+CO2(g)=NH2CO2NH4(s) △H=-159kJ·mol-1
NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) △H=+72kJ·mol-1
H2O(l)=H2O(g) △H=+44kJ·mol-1
则反应2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l) △H=______kJ·mol-1
(2)某温度下,向容积为100 ml的密闭容器中通入4molNH3和2molCO2发生反应2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g),物质X的浓度变化曲线如下图所示。
CO(NH2)2(s)+H2O(g),物质X的浓度变化曲线如下图所示。
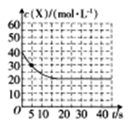
①前5s内,v(H2O)=__________。
②该条件下的平衡常数K=_______。
(3)T℃时,将等物质的量的NO和CO充入体积为2L的密闭容器中,保持温度和体积不变,反应过程(0——15min)中NO的物质的量随时间的变化如图所示。
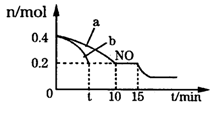
①平衡时若保持温度不变,再向容器中充入CO、N2各0.8mol,平衡将____(填“向左”“向右”或“不”)移动。
②图中a、b分别表示在一定温度下,使用质量相同但表面积不同的催化剂时,达到平衡过程中n(NO)的变化曲线,其中表示催化剂表面积较大的曲线是______(填“a”或“b”)。
③15min时,若改变外界反应条件,导致n(NO)发生如图所示的变化,则改变的条件可能是____。
(4)垃圾渗滤液中含有大量的氨氮物质(用NH3表示)和氯化物,把垃圾渗滤液加入如图所示的电解池(电极为惰性材料)中进行电解除去NH3,净化污水。该净化过程分两步:第一步电解产生氧化剂,第二步氧化剂氧化氨氮物质生成N2。
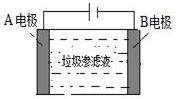
①写出第二步反应的化学方程式_________。
②若垃圾渗滤液中氨氮物质的含量为1.7%,则理论上电解1t该污水,电路中转移的电子数为________。
-
氨是化学实验室及化工生产中的重要物质,应用广泛。N2(g)+3H2(g) 2NH3(g) ΔH=-92.2kJ/mol
2NH3(g) ΔH=-92.2kJ/mol
(1)在恒温恒容密闭容器中进行合成氨反应,起始投料时各物质浓度如下表:
| N2 | H2 | NH3 |
| 投料Ⅰ | 1.0 mol/L | 3.0 mol /L | 0 |
| 投料Ⅱ | 0.5 mol/L | 1.5 mol/L | 1.0 mol/L |
①按投料Ⅰ进行反应,测得达到化学平衡状态时H2的转化率为40%,则该温度下合成氨反应的平衡常数表达式为_____________。
②按投料Ⅱ进行反应,起始时反应进行的方向为________(填“正向”或“逆向”)。
③若升高温度,则合成氨反应的化学平衡常数________(填“变大”、“变小”或“不变”)。
(2)L(L1、L2)、X可分别代表压强或温度。下图表示L一定时,合成氨反应中H2(g)的平衡转化率随X的变化关系。
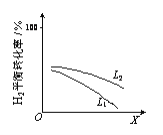
ⅰ X代表的物理量是______。
ⅱ 判断L1、L2的大小关系,并简述理由:______。
(3)电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下:
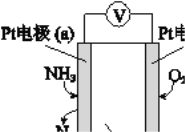
① 电极b上发生的是______反应(填“氧化”或“还原”)
② 写出电极a的电极反应式:_________。
-
氨是化学实验室及化工生产中的重要物质,应用广泛。N2(g)+3H2(g) 2NH3(g) ΔH=-92.2kJ/mol
2NH3(g) ΔH=-92.2kJ/mol
(1)在恒温恒容密闭容器中进行合成氨反应,起始投料时各物质浓度如下表:
| N2 | H2 | NH3 |
| 投料Ⅰ | 1.0 mol/L | 3.0 mol /L | 0 |
| 投料Ⅱ | 0.5 mol/L | 1.5 mol/L | 1.0 mol/L |
①按投料Ⅰ进行反应,测得达到化学平衡状态时H2的转化率为40%,则该温度下合成氨反应的平衡常数表达式为_____________。
②按投料Ⅱ进行反应,起始时反应进行的方向为________(填“正向”或“逆向”)。
③若升高温度,则合成氨反应的化学平衡常数________(填“变大”、“变小”或“不变”)。
(2)L(L1、L2)、X可分别代表压强或温度。下图表示L一定时,合成氨反应中H2(g)的平衡转化率随X的变化关系。
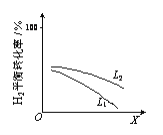
ⅰ X代表的物理量是______。
ⅱ 判断L1、L2的大小关系,并简述理由:______。
(3)电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下:
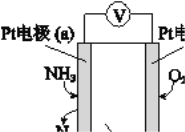
① 电极b上发生的是______反应(填“氧化”或“还原”)
② 写出电极a的电极反应式:_________。
-
已知氨气在生活、生产、科研中有极广泛用途。
(1)已知反应Ⅰ:2NH3(g)+CO2(g)═NH2CO2NH4(s)△H=﹣159.5kJ/mol
反应Ⅱ:NH2CO2NH4(s)═CO(NH2)2 (s)+H2O(g)△H= + 116.5kJ/mol
反应Ⅲ:H2O(l)═H2O(g)△H= + 44.0kJ/mol
工业上以CO2、NH3为原料合成尿素和液态水的热化学方程式为___________________,该反应在_________条件下可以自发进行(填“高温”、“低温”或“任何温度下”);
(2)查阅资料可知:常温下,K稳[Ag(NH3)2+]=1.00×107,Ksp[AgCl]=2.50×10﹣10.
①银氨溶液中存在平衡:Ag+(aq)+2NH3(aq) Ag(NH3)2+ (aq),该反应平衡常数的表达式为K稳=_______________;
Ag(NH3)2+ (aq),该反应平衡常数的表达式为K稳=_______________;
②计算得到可逆反应AgCl (s)+2NH3(aq) Ag(NH3)2+ (aq)+Cl﹣(aq)的化学平衡常数K=_________________________;在1L浓度为1mol/L氨水中最多可以溶解AgCl为_______mol(保留2位有效数字)。
Ag(NH3)2+ (aq)+Cl﹣(aq)的化学平衡常数K=_________________________;在1L浓度为1mol/L氨水中最多可以溶解AgCl为_______mol(保留2位有效数字)。
-
已知氨气在生活、生产、科研中有极广泛用途。
(1)已知反应Ⅰ:2NH3(g)+CO2(g)═NH2CO2NH4(s)△H=﹣159.5kJ/mol
反应Ⅱ:NH2CO2NH4(s)═CO(NH2)2 (s)+H2O(g)△H= + 116.5kJ/mol
反应Ⅲ:H2O(l)═H2O(g)△H= + 44.0kJ/mol
工业上以CO2、NH3为原料合成尿素和液态水的热化学方程式为___________________,该反应在_________条件下可以自发进行(填“高温”、“低温”或“任何温度下”);
(2)查阅资料可知:常温下,K稳[Ag(NH3)2+]=1.00×107,Ksp[AgCl]=2.50×10﹣10.
①银氨溶液中存在平衡:Ag+(aq)+2NH3(aq) Ag(NH3)2+ (aq),该反应平衡常数的表达式为K稳=_______________;
Ag(NH3)2+ (aq),该反应平衡常数的表达式为K稳=_______________;
②计算得到可逆反应AgCl (s)+2NH3(aq) Ag(NH3)2+ (aq)+Cl﹣(aq)的化学平衡常数K=_________________________;在1L浓度为1mol/L氨水中最多可以溶解AgCl为_______mol(保留2位有效数字)。
Ag(NH3)2+ (aq)+Cl﹣(aq)的化学平衡常数K=_________________________;在1L浓度为1mol/L氨水中最多可以溶解AgCl为_______mol(保留2位有效数字)。
-
(12分)二氧化碳是用途非常广泛的化工基础原料,回答下列问题:
(1)工业上可以用CO2来生产燃料甲醇。
已知:CO2(g)+3H2(g) CH3OH(l)+H2O(l) △H=-130kJ·mol-1
CH3OH(l)+H2O(l) △H=-130kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H=-572kJ·mol-1
CH3OH(l)的燃烧热△H=___________。
(2)在催化剂作用下,CO2和CH4可直接转化为乙酸:CO2(g)+CH4(g)=CH3COOH(g) △H>0在不同温度下乙酸的生成速率变化如图所示。
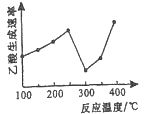
①当温度在250℃—300℃范围时,乙酸的生成速率减慢的主要原因是_________。
②欲使乙酸的平衡产率提高,应采取的措施是_____________(任写一条措施即可)。
(3)一定条件下,在密闭容器中发生反应:2CO(g) C(s)+CO2(g)。
C(s)+CO2(g)。

①下列能说明该反应达到平衡的是___________。
A.容器内混合物的质量不变
B.CO和CO2的物质的量之比不再变化
C.混合气体的平均摩尔质量不再变化
D.形成amolC=O键的同时断裂amolC O键
O键
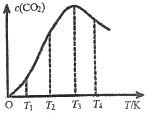
②向某恒容容器中通入一定量的CO发生上述反应,在不同温度下CO2的物质的量浓度c(CO2)随温度的变化如上图所示,则该反应为________(填“放热”或“吸热”)反应。
③向容积可变的某恒压容器中通入amolCO,TC时反应经过10min达平衡,CO的体积分数为75%。CO的平衡转化率为_______。在容积改变的条件下,反应速率可用单位时间内反应物或生成物的物质的量变化来表示,则0-10min内平均反应速率v(CO2)=__________。
-
二氧化碳是用途非常广泛的化工基础原料,回答下列问题:
(1)工业上可以用CO2来生产燃料甲醇。
已知:CO2(g)+3H2(g) CH3OH(l)+H2O(l) △H=-130kJ·mol-1
CH3OH(l)+H2O(l) △H=-130kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H=-572kJ·mol-1
CH3OH(l)的燃烧热△H=___________。
(2)在催化剂作用下,CO2和CH4可直接转化为乙酸:CO2(g)+CH4(g)=CH3COOH(g) △H>0在不同温度下乙酸的生成速率变化如图所示。

①当温度在250℃—300℃范围时,乙酸的生成速率减慢的主要原因是_________。
②欲使乙酸的平衡产率提高,应采取的措施是_____________(任写一条措施即可)。
(3)一定条件下,在密闭容器中发生反应:2CO(g) C(s)+CO2(g)。
C(s)+CO2(g)。
①下列能说明该反应达到平衡的是___________。
A.容器内混合物的质量不变 B.CO和CO2的物质的量之比不再变化
C.混合气体的平均摩尔质量不再变化 D.形成amolC=O键的同时断裂amolC O键
O键
②向某恒容容器中通入一定量的CO发生上述反应,在不同温度下CO2的物质的量浓度c(CO2)随温度的变化如上图所示,则该反应为________(填“放热”或“吸热”)反应。
③向容积可变的某恒压容器中通入amolCO,TC时反应经过10min达平衡,CO的体积分数为75%。CO的平衡转化率为_______。在容积改变的条件下,反应速率可用单位时间内反应物或生成物的物质的量变化来表示,则0-10min内平均反应速率v(CO2)=__________。
2 NH3 (g) H =_____kJ·mol-1
2NH3,测得各组分浓度随时间变化如图8所示。














