-
下列变化不需要破坏化学键的是( )
A. 氯化铵受热分解 B. 干冰气化 C. 食盐熔化 D. 氯化氢溶于水
难度: 中等查看答案及解析
-
元素在周期表中的位置,反映了元素的原子结构和元素的性质。下列说法正确的( )
A. 同一元素不可能既表现金属性,又表现非金属性
B. 第三周期元素的最高正化合价等于它所处的主族序数
C. 短周期元素形成离子后,最外层都达到8电子稳定结构
D. 同一主族的元素的原子,最外层电子数相同,化学性质完全相同
难度: 中等查看答案及解析
-
CO、H2、C2H5OH三种物质燃烧的热化学方程式如下:
①CO(g)+1/2O2(g)═CO2(g) △H1=a kJ/mol;
②H2(g)+1/2O2(g)═H2O(g) △H2=b kJ/mol;
③C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g) △H3=c kJ/mol。
下列说法正确的是
A. △H1>0
B. 2H2O(l)═2H2(g)+O2(g) △H=-2b kJ/mol
C. CO2与H2合成C2H5OH反应的原子利用率为100%
D. 2CO(g)+4H2(g)═H2O(g)+C2H5OH(l) △H=(2a+4b-c) kJ/mol
难度: 中等查看答案及解析
-
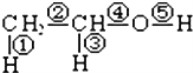
正确掌握好化学用语是学好化学的基础,下列有关表述正确的是( )
A. Cl﹣ 的电子排布式1s22s22p63s23p6
B. 氟原子结构示意图:
C. H2S的电子式:
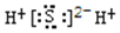
D. S原子核外电子的轨道表示式为:
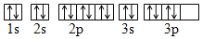
难度: 简单查看答案及解析
-
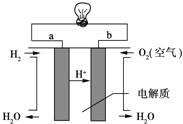
利用如图所示原电池可测量空气中Cl2含量,其中电解质是Ag+可以自由移动的固体物质。下列分析不正确的是( )
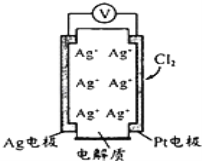
A. 电子经外电路流向Pt电极
B. 电池工作时,电解质中Ag+数目减少
C. 正极反应:C12+2e﹣+2Ag+=2AgCl
D. 空气中c(C12)越大,Ag极消耗速率越快
难度: 中等查看答案及解析
-
下列反应中,属于取代反应的是( )
①CH2=CH2+Br2
CH2Br﹣CH2Br ②2CH3CH2OH+O2
2CH3CHO+2H2O
③CH3COOH+CH3CH2OH
CH3COOC2H5+H2O ④C6H6+Br2
C6H5Br+HBr↑
A. ①② B. ②③ C. ③④ D. ①④
难度: 简单查看答案及解析
-
现有淀粉溶液、鸡蛋清、葡萄糖溶液,区别它们时,下列试剂和对应现象正确的( )
试剂:①新制Cu(OH)2悬浊液 ②碘水 ③浓硝酸
现象:a.变蓝色 b.砖红色沉淀 c.变黄色.
A. ②﹣a、①﹣c、③﹣b B. ③﹣a、②﹣c、①﹣b
C. ②﹣a、③﹣c、①﹣b D. ②﹣c、③﹣a、①﹣b
难度: 简单查看答案及解析
-
一定条件下某混合气体由两种气态烃组成.2.24L该混合气体完全燃烧后,得到4.48L二氧化碳(气体已折算成标准状况)和4.5g水.则这两种气体可能是( )
A. CH4和C2H4 B. C2H4 和C5H8 C. C2H4 和C3H4 D. C2H4 和C2H6
难度: 困难查看答案及解析
-
下列关于苯的叙述正确的是
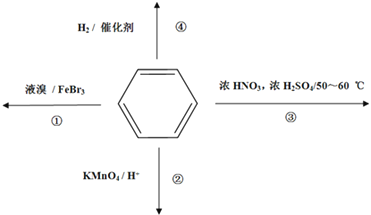
A. 反应①常温下能进行,其有机产物为
B. 反应②不发生,但是仍有分层现象,紫色层在下层
C. 反应③为加成反应,产物是三硝基甲苯
D. 反应 ④中1mol苯最多与3 mol H2发生加成反应,是因为苯分子含有三个碳碳双键
难度: 中等查看答案及解析
-
为了从海带浸取液中提取碘,某同学设计了如图实验方案:下列说法正确的是( )
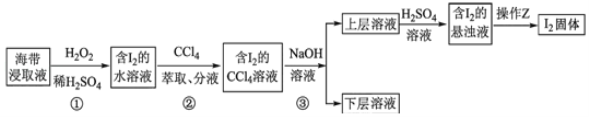
A. ①中反应的离子方程式:2I﹣+H2O2═I2+2OH﹣
B. ②中分液时含I2的CCl4溶液从分液漏斗上口倒出
C. ③中得到的上层溶液中含有I﹣
D. 操作Z的名称是加热
难度: 中等查看答案及解析
-
有A、B、D、E四种金属,当A、B组成原电池时,电子流动方向A→B;当A、D组成原电池时,A为正极;B与E构成原电池时,电极反应式为:E2﹣+2e﹣→E,B﹣2e﹣→B2+则A、B、D、E金属性由强到弱的顺序为( )
A. A>B>E>D B. A>B>D>E
C. D>E>A>B D. D>A>B>E
难度: 中等查看答案及解析
-
M、N、Q、P为四种短周期元素,已知M、Q同主族,N、P同周期;M的气态氢化物比Q的稳定;N的阳离子比P的阳离子氧化性强;N的阳离子比Q的阴离子少一个电子层。下列表示中,正确的是
A. 原子序数:M>N>Q>P B. 非金属性强弱:Q>M
C. 原子半径:P>N>Q>M D. 简单离子半径:P>N>Q>M
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 电离能大的元素,不易失电子,易得到电子,表现非金属性
B. 电离能大的元素其电负性必然也大
C. 电负性最大的非金属元素形成的含氧酸的酸性最强
D. 电离能最小的元素形成的氧化物的水化物的碱性最强
难度: 中等查看答案及解析
-
下列有关说法正确的是( )
A. 海水淡化可以解决淡水供应危机,向海水中加入明矾可以使海水淡化
B. 燃煤中加入生石灰、汽车中加装尾气处理装置、利用制造全降解塑料都能有效减少环境污染
C. 乙醇、过氧化氢、次氯酸钠等消毒液均可以将病毒氧化而达到消毒的目的
D. 铝合金的大量使用归功于人们能使用焦炭等还原剂从氧化铝中获得铝
难度: 中等查看答案及解析
-
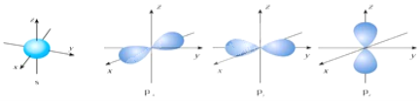
下列描述中正确的是( )
A. CS2 为空间构型为V形的极性分子
B. 双原子或多原子形成的气体单质中,一定有σ键,可能有π键
C. 氢原子电子云的一个小黑点表示一个电子
D. HCN、SiF4和SO32﹣ 的中心原子均为sp3杂化
难度: 中等查看答案及解析
-
根据等电子原理,等电子体之间结构相似、物理性质也相近。以下各组粒子不能互称为等电子体的是( )
A. CO和N2 B. O3和SO2
C. CO2和N2O D. N2H4和C2H4
难度: 中等查看答案及解析
-
某饱和一元醇C5H12O的同分异构体中,能催化氧化成醛的有( )
A. 2种 B. 3种 C. 4种 D. 5种
难度: 简单查看答案及解析