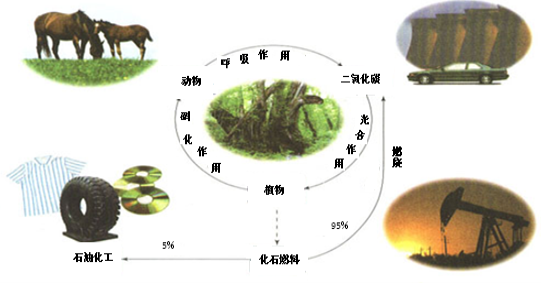
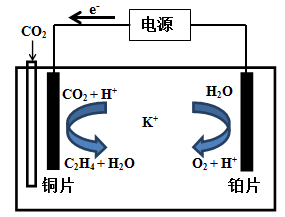
-
下列过程不涉及氧化还原反应的是
A.火法炼铜
B.中和滴定
C.酿酒
D. 制银镜



难度: 简单查看答案及解析
-
下列说法正确的是
A.大量燃烧化石燃料是造成雾霾的一种重要因素
B.食品中的抗氧化剂本身是难于氧化的物质
C.含SO42-的澄清溶液中不会含Ba2+
D.凡溶于水能电离出H+离子的化合物均属于酸
难度: 简单查看答案及解析
-
下列有关性质的比较,不能用元素周期律解释的是
A.热稳定性H2O > H2S B.还原性 Ⅰ— > Br— > Cl—
C.金属性 K > Na D.酸性 HCI > HF
难度: 中等查看答案及解析
-
有甲(
)、乙(
)两种有机物,下列说法中不正确的是( )
A.可用新制的氢氧化铜悬浊液区分这两种有机物
B.1 mol甲与H2在一定条件下反应,最多消耗3 mol H2
C.甲、乙互为同分异构体
D.等物质的量的甲、乙分别与足量NaOH溶液反应消耗NaOH的量相同
难度: 中等查看答案及解析
-
下列关于各图像的解释或结论不正确的是
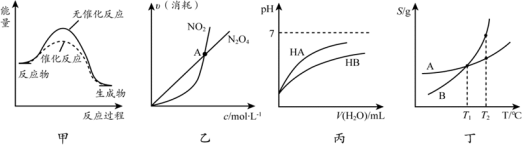
A.由甲可知:使用催化剂不影响反应热
B.由乙可知:对于恒温恒容条件下的反应2NO2 (g)
N2O4 (g),A点为平衡状态
C.由丙可知:同温度、同浓度的NaA溶液与NaB溶液相比,其pH前者小于后者
D.由丁可知:将T1 ℃ 的A、B饱和溶液升温至T2 ℃时,A与B溶液的质量分数相等
难度: 困难查看答案及解析
-
下列有关实验现象和解释或结论都正确的选项是
选项
实验操作
现象
解释或结论
A
将电石与水反应产生的气体通入酸性高锰酸钾溶液
紫色褪去
证明有乙炔生成
B
将滴有酚酞的碳酸钠溶液加热
红色变深
水解过程是吸热的
C
把Cl2通入紫色石蕊试液中
紫色褪去
Cl2具有漂白性
D
向碳酸钙粉末中滴加稀盐酸
有气泡产生
非金属性氯强于碳
难度: 中等查看答案及解析
-
常温下,有下列四种溶液:
①
②
③
④
0.1mol/L
盐酸
pH = 3
盐酸
0.1mol/L
氨水
pH = 11
氨水
下列说法正确的是
A.由水电离出的c(H+):①>③
B.③稀释到原来的100倍后,pH与④相同
C.①与③混合,若溶液pH = 7,则V(盐酸)>V(氨水)
D.②与④混合,若溶液显碱性,则所得溶液中离子浓度可能为:c(NH4+)>c(OH—)>c(Cl—)>c(H+)
难度: 困难查看答案及解析