-
甲酸是一种有机酸,又叫蚁酸。蚊子、蜂、蚂蚁等昆虫叮咬人时,会向人体射入蚁酸,使皮肤红肿、瘙痒,甚至疼痛。要消除这种症状,可在叮咬处涂抹下列物质中的
已知家庭中一些常见物质的pH:食醋-4;牙膏-9;食盐水-7;肥皂水-10;火碱液-13
A.火碱液 B.食盐水 C.牙膏或肥皂水 D.食醋
难度: 简单查看答案及解析
-
将电解质分为强、弱电解质的依据是
A.属于离子化合物还是共价化合物 B.在一定条件下的电离程度
C.熔融状态下是否完全电离 D.溶于水后的导电能力是强还是弱
难度: 简单查看答案及解析
-
下列有机物不是同一种物质的是

难度: 简单查看答案及解析
-
某烷烃的一种同分异构体与氯气发生取代反应只能生成一种一氯代物,该烷烃的分子式可能是
A.C5H12 B.C6H14 C.C3H8 D.C2H6
难度: 中等查看答案及解析
-
将0.1mol/L的下列物质的水溶液,从常温加热到80℃(不计水的蒸发),溶液的pH不变的是
A.NaCl B.(NH4)2SO4 C.Ba(OH)2 D.H2SO4
难度: 中等查看答案及解析
-
下列说法正确的是
A.物质的量浓度和体积都相同的盐酸和醋酸溶液,在与足量锌反应时,起始时二者产生H2速率基本相等
B.100 mL 1 mol·L-1的盐酸和50 mL 2 mol·L-1的盐酸,分别与足量的锌反应时,两者放出H2速率和质量均相等
C.100 mL pH=3的H2SO4和HCl溶液,与足量锌反应后,放出H2的质量相等
D.100 mL pH=3的盐酸与醋酸溶液,与足量锌反应后,所得H2的质量相等
难度: 简单查看答案及解析
-
已知某温度下水的离子积KW=3.4×10-15.取该温度下浓度相同的NaOH和HCl溶液,以3∶2体积比相混合,所得溶液的pH等于12,则原溶液的浓度为
A.0.01mol·L-1 B.0.017mol·L-1
C.0.05mol·L-1 D.0.50mol·L-1
难度: 中等查看答案及解析
-
室温下0.1mol/L的NH4CN溶液的pH等于9.32。下列说法错误的是
A.上述溶液能使甲基橙试剂变黄色,石蕊试液变蓝
B.室温下,HCN是比NH3·H2O更弱的电解质
C.上述溶液中NH4+的水解程度大于CN-的水解程度
D.室温下,0.1mol/LNaCN溶液中,CN-的水解程度小于上述溶液中CN-的水解程度
难度: 简单查看答案及解析
-
下列说法正确的是
A.酸式盐的水溶液一定显碱性
B.醋酸铵溶液呈中性是因为溶液中H+的物质的量和OH-的物质的量相等
C.NaHSO3溶液的PH大于Na2SO4溶液的PH
D.只要酸与碱的物质的量浓度和体积分别相等,它们反应后的溶液就呈中性
难度: 简单查看答案及解析
-
下列各方程式中,属于电离过程的是
A.CO2+H2O
H2CO3 B.OH-+HS-
S2-+H2O
C.HS-+H2O
H3O++S2- D.HS-+H2O
H2S+OH-
难度: 简单查看答案及解析
-
下列各组离子中,因相互促进水解,而不能大量共存的是
A.Al3+、SO42-、CO32-、Cl-
B.Na+、HCO3-、AlO2-、Cl-
C.H+、HS-、Na+、SO32-
D.OH-、Na+、K+、HCO3-
难度: 简单查看答案及解析
-
为了防止热带鱼池中水藻的生长,需保持水中Cu2+的浓度约1.2×10-5 mol·L-1。为避免在每次换池水时溶液浓度的改变,可把适当的含铜化合物放在池底,其饱和溶液提供适当的Cu2+。已知CuS、Cu(OH)2、CuCO3的Ksp值依次为1.3×10-36、2.2×10-20、1.4×10-10,下列四种物质中,能满足池水浓度要求的是
A.CuS B.Cu(NO3)2 C.Cu(OH)2 D.CuCO3
难度: 中等查看答案及解析
-
下列物质中,不能和氯气发生取代反应的是
A.C8H18 B.C2H5Cl C.CH2Cl2 D.CCl4
难度: 简单查看答案及解析
-
甲烷和丙烷混和气的密度与同温同压下一氧化碳的密度相同,混和气中甲烷和丙烷的体积比是
A.4:3 B.3:4 C.2:1 D.1:1
难度: 中等查看答案及解析
-
在25℃时,物质的浓度相等的NH4Cl、CH3COONH4、NH4HSO4的溶液中,其对应溶液pH分别为a、b、c(单位为mol·L-1),下列判断正确的是
A.a=b=c B.a=c>b C.b>a>c D.c>a>b
难度: 中等查看答案及解析
-
化工生产中常用MnS作为沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+MnS(s)
CuS(s)+Mn2+(aq),下列说法正确的是
A.MnS的Ksp比CuS的Ksp小
B.该反应达平衡时c(Mn2+)=c(Cu2+)
C.往平衡体系中加入少量CuSO4固体后,c(Cu2+)减小,c(Mn2+)变大
D.设该反应的平衡常数为K,则该关系成立:K×Ksp(CuS)=Ksp(MnS)
难度: 中等查看答案及解析
-
下列说法错误的是
A.常温下,若醋酸钠与醋酸的混合溶液pH=7,则C(Na+)=c(CH3COO-)
B.某温度下,pH=6的NaCl溶液中离子浓度的大小关系:c(Na+)= c(Cl-)>c(H+)>c(OH-)
C.若2a mol·L-1HCN与a mol·L-1 NaOH溶液等体积混合后所得溶液中c(Na+)>c(CN-),则混合溶液pH>7
D.含0.1 mol NaHCO3和0.2molNa2CO3的混合液中:c(Na+)+c(H+)=c(OH-)+c(HCO3—)+2c(CO32—)
难度: 困难查看答案及解析
-
25℃ 时,水的离子积为Kw ,该温度下将 a mol ·L-盐酸 与b mol·L-1氨水等体积混合,若恰好完全反应,下列结论中不正确的是
A.混合液中:c(H+ ) ≤
B.混合液中:c(NH3·H2O)+c(NH4+)=0.5a mol·L-1
C.a = b
D.混合液中:c(H+)+c(NH4+)= c(OH-)+c(Cl-)
难度: 简单查看答案及解析
-
下列说法正确的是
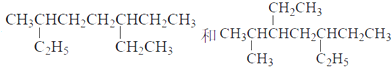
A.主链碳原子数均为7个
B.主链含5个碳原子,有甲基、乙基2个支链的烷烃有三种
C. 新戊烷、正丁烷、异丁烷和丙烷的熔沸点依次降低
D.C7H16的烷烃中,含有3个甲基的同分异构体有2种
难度: 简单查看答案及解析
-
在等物质的量浓度的两种弱酸的钠盐(NaR、NaR′)溶液中分别通入适量的CO2,发生如下反应:NaR+CO2+H2O=HR+NaHCO3,2NaR′+CO2+H2O=2HR′+ Na2CO3。现有物质的量浓度相同的四种溶液:①HR②HR′③NaR④NaR′,由水电离出c(OH-)大小顺序是
A.①>②>③>④ B.②>①>④>③
C.③>④>①>② D.④>③>②>①
难度: 中等查看答案及解析
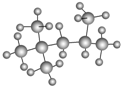 的名称(系统命名法)是
的名称(系统命名法)是