-
广义的水解观认为:无论是盐的水解还是非盐的水解,其最终结果是反应中各物质和水分别解离成两部分,然后两两重新组合成新的物质.根据上述信息,下列说法不正确的是( )
A.CaO2的水解产物是Ca(OH)2和H2O2
B.PCl3的水解产物是HClO和PH3
C.NaClO的水解产物之一是HClO
D.Mg3N2的水解产物是两种碱性物质难度: 中等查看答案及解析
-
有关晶体的下列说法中正确的是( )
A.氯化钠熔化时离子键未被破坏
B.原子晶体中共价键越强,熔点越高
C.冰融化时水分子中共价键发生断裂
D.晶体中分子间作用力越大,分子越稳定难度: 中等查看答案及解析
-
以下各项研究:①高分子材料的合成与使用;②新型药物的研究与生产;③高效能源的开发与使用;④新型防病毒疫苗的研制与生产.其中涉及化学研究领域的是( )
A.①③
B.②④
C.①②③
D.①②③④难度: 中等查看答案及解析
-
目前,家庭装饰已成为一种时尚.随着装饰材料进入百姓家庭,新装修居室中常会缓慢释放出来污染物,进而影响人体健康.这些污染物中最常见的是( )
A.CO和SO2
B.O3和Cl2
C.SO2和NO2
D.HCHO和C6H6及其同系物难度: 中等查看答案及解析
-
下列化学用语表达正确的是( )
A.丙三醇的化学式:C3H6O3
B.乙醛的结构简式:CH3CHO
C.二氧化碳的结构式:O-C-O
D.Mg原子结构示意图:难度: 中等查看答案及解析
-
下列说法错误的是( )
A.在分子组成上相差一个或若干个CH2原子团的物质互称为同分异构体
B.离子方程式可以表示同一类型的离子反应,它反映了离子反应的实质
C.元素性质的周期性变化是元素原子的核外电子排布的周期性变化的必然结果
D.物质的性质是影响参加反应的物质的化学反应速率的重要因素难度: 中等查看答案及解析
-
下列有关炼铁和炼钢的说法错误的是( )
A.炼铁与炼钢分别在高炉和转炉中进行
B.炼铁是铁矿石在高温下被还原的过程
C.炼钢是通过氧化反应除去生铁中的碳单质
D.炼铁过程中加入石灰石的目的是除去脉石难度: 中等查看答案及解析
-
化学反应前后肯定没有变化的是( )
①原子数目;②分子数目;③元素种类;④物质的总质量;⑤物质的种类.
A.①④
B.①③④
C.①③⑤
D.①②③④难度: 中等查看答案及解析
-
下列各项中的两个量,其比值一定为1:2的是( )
A.固体Na2O2中阴离子与阳离子的个数
B.相同温度下0.lmol/L的CH3COOH与0.2mol/L的CH3COOH溶液中的c(H+)
C.液面在“0”刻度时,25mL滴定管和50mL滴定管所盛溶液的体积
D.在反应2H2S+SO2→3S↓+2H2O中氧化产物与还原产物的质量难度: 中等查看答案及解析
-
图表示的是钢铁在海水中的锈蚀过程,以下有关说法正确的是( )
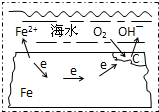
A.该金属腐蚀过程为吸氢腐蚀
B.正极为C,发生的反应为氧化反应
C.在酸性条件下发生的是吸氧腐蚀
D.正极反应为:O2+2H2O+4e→4OH-难度: 中等查看答案及解析
-
下列各组离子能大量共存的是( )
A.使酚酞试液变红的无色溶液中:Mg2+、NH4+、CO32-、Cl-
B.能与金属铝反应放出氢气的溶液中:K+、Al3+、NO3-、Cl-
C.常温下水电离出的c(H+)•c(OH-)=10-20的溶液中:Na+、K+、Cl-、SO42-
D.能使甲基橙溶液变红的溶液中:K+、Fe2+、Cl-、NO3-难度: 中等查看答案及解析
-
常温下,已知氨水的密度随其浓度增大而减小.将10%的氨水和20%的氨水等体积混合,则混合后溶液中溶质的质量分数为
( )
A.大于15%
B.小于15%
C.等于15%
D.无法判断难度: 中等查看答案及解析
-
以下三种有机物是某些药物中的有效成分:

下列有关它们的说法正确的是( )
A.三种有机物都是芳香烃
B.三种有机物苯环上的氢原子若被氯原子取代,其一氯代物都只有2种
C.将等物质的量的三种物质加入NaOH溶液中,阿司匹林消耗NaOH最多
D.1mol对羟基桂皮酸最多可以和1molBr2反应难度: 中等查看答案及解析
-
如图是198K时N2与H2反应过程中使用催化剂和不使用催化剂条件下能量变化的曲线图.下列叙述正确的是( )
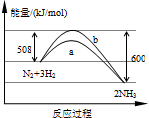
A.反应物总能量小于生成物总能量,反应为吸热反应
B.a曲线是加入催化剂时的能量变化曲线
C.使用催化剂可以影响该化学反应的反应热大小
D.一定条件下在密闭容器中含有1mol氮气与3mol氢气,充分反应后放出热量92kJ难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数.下列叙述正确的是( )
A.0℃时,18g冰水混合物所含电子数为10NA
B.2L0.5mol/LNa2CO3溶液中含有离子总数为3NA
C.标准状况下,22.4L乙烷中所含共价键总数为6NA
D.铝与烧碱溶液反应产生22.4LH2(标准状况),电子转移数为3NA难度: 中等查看答案及解析
-
几种短周期元素的部分性质的数据见下表:
下列判断正确的是( )元素代号 L M Q R T 原子半径/nm 0.160 0.143 0.112 0.104 0.066 主要化合价 +2 +3 +2 +6、-2 -2
A.氢化物的稳定性为H2T<H2R
B.M与T形成的化合物为两性化合物
C.单质与稀盐酸反应的速率为L<Q
D.L2+与R2-的核外电子数相等难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A.硫化亚铁与硫酸反应制硫化氢:S2-+2H+→H2S↑
B.碳酸氢钙溶液中加入盐酸:CO32-+2H+→CO2↑+H2O
C.氯化亚铁溶液中加入少量溴水:Fe2++Br2→Fe3++2Br-
D.苯酚钠溶于醋酸溶液:C6H5O-+CH3COOH→C6H5OH+CH3COO-难度: 中等查看答案及解析
-
下列有关工业生产的叙述正确的是( )
A.在侯氏制碱工业中采用循环操作,其目的是提高食盐的利用率,节约成本
B.合成氨生产中将氨气液化分离,可加快反应速率,提高N2、H2的转化率
C.硫酸工业中在接触室运用热交换技术,其目的是充分利用能源,提高生产效益
D.在硝酸工业中,为防止氮氧化物(NOx)污染环境,可以建高烟囱向高空排放难度: 中等查看答案及解析
-
以下反应均在密闭容器中进行,根据相应的图象,下列相关说法正确的是( )
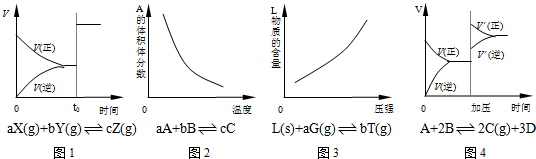
A.图1所示为t时改变某一条件时速率变化,则改变的条件一定是加入催化剂
B.图2所示为反应达到平衡时温度对化学平衡的影响,则正反应为放热反应
C.图3所示为反应达到平衡时压强对化学平衡的影响,则反应方程式中a<b
D.图4所示为平衡后加压时反应速率的变化,则A、B是气体、D为固体或液体难度: 中等查看答案及解析
-
某学生设计了如下除去某物质中杂质的方法:
其中正确的方法是( )序号 物质 杂质 方法 ① 甲烷 乙烯 将混合气体通入酸性高锰酸钾溶液 ② 乙酸乙酯 乙酸 用饱和碳酸钠溶液洗涤并分液 ③ CO2 SO2 将气体通过盛饱和碳酸钠溶液的洗气瓶 ④ 乙醇 乙酸 加足量生石灰,蒸馏
A.①②
B.②④
C.③④
D.②③难度: 中等查看答案及解析
-
标准状况下,将448mLCO2通入到300mL 0.1mol/L的NaOH溶液,充分反应后,溶液中离子的关系正确的是( )
A.c(Na+)>c(HCO3-)+2c(CO32-)
B.c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)
C.c(Na+)>c(OH-)>c(CO32-)>c(HCO3-)
D.c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-)难度: 中等查看答案及解析
-
一定质量的某硝酸钾样品中不含可溶性杂质,在10℃时加一定量蒸馏水使之充分溶解,残留固体的质量为250g,若升温至40℃,残留固体的质量为120g;升温至70℃,残留固体的质量为20g.已知KNO3在不同温度下的溶解度:
对该样品的推断正确的是( )温度(℃) 10 40 55 70 溶解度(g/100g 水) 20 65 100 140
A.该硝酸钾样品一定为纯净物
B.40℃时溶于水的硝酸钾为130g
C.70℃硝酸钾溶液为饱和溶液
D.55℃左右时硝酸钾完全溶解难度: 中等查看答案及解析



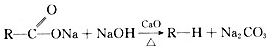
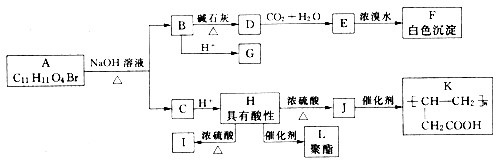
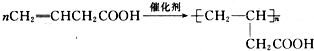 ;
;