-
230Th和232Th是钍的两种同位素,232Th可以转化成233U。下列说法中正确的是 ( )
A. Th元素的质量数是232 B. Th元素的相对原子质量是231
C. 232Th转换成233U是化学变化 D. 230Th和232Th的化学性质相同
难度: 中等查看答案及解析
-
下列说法正确的是 ( )
A.冰融化时,分子中H—O键发生断裂
B.随着电子层数的增加,卤化物CX4分子间作用力逐渐增大,所以它们相应的熔沸点也逐渐升高
C.由于H—O键比H—S键牢固,所以水的熔沸点比H2S高
D.在由分子所构成的物质中,分子间作用力越大,该物质越稳定
难度: 中等查看答案及解析
-
某元素的一种同位素X的原子质量数为A,含N个中子,它与1H原子组成HmX分子。在a g HmX中所含质子的物质的量是( )
A.
(A-N+m) mol B.
(A-N) mol
C.
(A-N) mol D.
(A-N+m) mol
难度: 困难查看答案及解析
-
有
和
两种粒子,下列叙述正确的是( )
A. 一定都是由质子、中子、电子构成的
B. 化学性质几乎完全相同
C. 质子数一定相等,质量数和中子数一定不相等
D. 核电荷数和核外电子数一定相等
难度: 中等查看答案及解析
-
国际无机化学命名委员会将元素周期表原先的主、副族族号取消,从左往右改为18列,碱金属为第1列,稀有气体为第18列,按这个规定,下列说法不正确的是 ( )
A. 不仅有第2列元素的原子最外层有2个电子
B. 第3~12列元素全为金属
C. 第3列元素种类最多
D. 第16、17列元素都是非金属元素
难度: 中等查看答案及解析
-
下列关于卤族元素由上到下性质递变的叙述,正确的是 ( )
①单质的氧化性增强 ②单质的颜色加深 ③气态氢化物的稳定性增强
④单质的沸点升高 ⑤阴离子的还原性增强
A. ①②③ B. ②③④ C. ②④⑤ D. ④⑤
难度: 中等查看答案及解析
-
砹是原子序数最大的卤族元素,根据卤素性质的递变规律,对砹及其化合物的叙述,正确的是( )
A. 与H2化合能力:At2>I2
B. 砹在常温下为白色固体
C. 砹原子的最外电子层上有7个电子
D. 砹易溶于水,难溶于四氯化碳
难度: 简单查看答案及解析
-
在元素周期表中,铂的表示如图所示,下列对图示解读正确的是 ( )
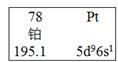
A. 铂是非金属元素,在常温下呈固态
B. “78”是铂的原子序数
C. “195.1”是铂的质量数
D. 铂的名称为Pt
难度: 简单查看答案及解析
-
根据离子方程式 [ ]+XO
+6H+===3X2+3H2O判断,下列说法正确的是 ( )
A. X2的电子式为X⋮⋮X B. X位于元素周期表中第ⅤA族
C. X元素原子的最外层有7个电子 D. X可能位于元素周期表中第二周期
难度: 困难查看答案及解析
-
下列结论错误的是 ( )
①微粒半径:K+>Al3+>S2->Cl- ②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③离子的还原性:S2->Cl->Br->I- ④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO4 ⑥非金属性:O>N>P>Si
⑦金属性:Be<Mg<Ca<K
A. 只有① B. ①③⑤ C. ②④⑤⑥⑦ D. ②④⑥
难度: 中等查看答案及解析
-
下列关于原子结构、元素性质的说法正确的是 ( )
A. 非金属元素组成的化合物中只含共价键
B. ⅠA族金属元素是同周期中金属性最强的元素
C. 同种元素的原子均有相同的质子数和中子数
D. ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强
难度: 中等查看答案及解析
-
下列反应既属于非氧化还原反应,又属于吸热反应的是 ( )
A.铝片和稀盐酸反应
B.Ba(OH)2·8H2O与NH4Cl的反应
C.灼热的碳与二氧化碳的反应
D.甲烷在氧气中的燃烧
难度: 简单查看答案及解析
-
下列有关能源与能量的说法正确的是 ( )
A.煤和石油是经过亿万年形成的,亿万年后煤和石油还会生成,故二者属可再生能源
B.蒸汽属于一次能源
C.凡经过加热而发生的反应都是吸热反应,常温下进行的反应都是放热反应
D.反应物和生成物的总能量决定反应是放热还是吸热
难度: 简单查看答案及解析
-
已知在25°C、101 kPa下,1 g C8H18(辛烷)燃烧生成CO2和液态水时放热48.40 kJ。表示上述反应的热化学方程式正确的是 ( )
A.C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(g) ΔH=-5518 kJ/mol
B.C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(l) ΔH=-5518 kJ/mol
C.C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(l) ΔH=+5518 kJ/mol
D.C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(l) ΔH=-48.40 kJ/mol
难度: 中等查看答案及解析
-
在同温同压下,下列各组热化学方程式中,ΔH1>ΔH2的是 ( )
A.2H2(g)+O2(g)=2H2O(l) ΔH1 2H2(g)+O2(g)=2H2O(g) ΔH2
B.S(g)+O2(g)=SO2(g) ΔH1 S(s)+O2(g)=SO2(g) ΔH2
C.C(s)+O2(g)=CO(g) ΔH1 C(s)+O2(g)=CO2(g) ΔH2
D.H2(g)+Cl2(g)=2HCl(g) ΔH1 1/2H2(g)+1/2Cl2(g)=HCl(g) ΔH2
难度: 中等查看答案及解析
-
已知:Fe2O3(s)+
C(s)===
CO2(g)+2Fe(s) ΔH=+234.14 kJ/mol,
C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ/mol,
则2Fe(s)+
O2(g)===Fe2O3(s)的ΔH是 ( )
A.-824.4 kJ/mol B.-627.6 kJ/mol
C.-744.7 kJ/mol D.-169.4 kJ/mol
难度: 困难查看答案及解析
-
已知:C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol;2H2(g)+O2(g)=2H2O(g) ΔH=-483.6
kJ/mol。现有0.2 mol的炭粉和氢气组成的悬浮气,混合物在氧气中完全燃烧,共放出63.53 kJ热量,则混合物中C与H2的物质的量之比为 ( )
A.1∶1 B.1∶2 C.2∶3 D.3∶2
难度: 困难查看答案及解析
-
下列说法中不正确的是 ( )
A.金属的冶炼就是利用氧化还原反应原理,在一定条件下将金属从其化合物中还原出来
B.冶炼金属时,必须加入一种物质作为还原剂
C.金属由化合态变为游离态,都是被还原
D.金属单质被发现和应用得越早,其活动性一般越弱
难度: 中等查看答案及解析
-
将氢气通过10gCuO粉末加热片刻,冷却后剩余固体的质量为8.4g,那么下列计算正确的是 ( )
A.有1.6gH2O生成 B.铜的质量有8.4gCu生成
C.有80%的CuO被还原 D.实验过程中所消耗的氢气为0.2g
难度: 中等查看答案及解析
-
有0.4 g铁的氧化物,用足量的CO在高温下将其还原,把生成的CO2全部通入足量澄清石灰水中,得到0.75 g沉淀。这种铁的氧化物的化学式是 ( )
A.FeO B.Fe2O3 C.Fe3O4 D.FeO和Fe2O3
难度: 简单查看答案及解析