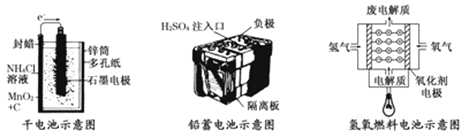
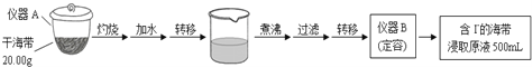
-
有X、Y两种元素,原子序数≤20,X的原子半径小于Y,且X、Y原子的最外层电子数相同(选项中m、n均为正整数)。下列说法正确的是
A. 若HnXOm为强酸,则X的氢化物溶于水一定显酸性
B. 若X(OH)n为强碱,则Y(OH)n也一定为强碱
C. 若X元素形成的单质是X2,则Y元素形成的单质一定是Y2
D. 若Y的最高正价为+m,则X的最高正价一定为+m
难度: 中等查看答案及解析
-
化学与环境、生产、生活等密切相关,下列说法不正确的是
A. 绿色化学的核心是利用化学原理对环境污染进行治理
B. 阻燃剂Al(OH)3受热分解时吸收能量
C. 利用高纯硅制造的太阳能电池板可将光能直接转化为电能
D. “一带一路”是现代丝绸之路的简称,丝绸的主要成分是蛋白质
难度: 中等查看答案及解析
-
下列有关化学用语表示正确的是
A. 中子数比质子数多1的磷原子:
B. 硫离子的结构示意图:
C. 次氯酸钠的电子式:
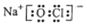 D. 淀粉的结构简式:(C6H10O5)n
D. 淀粉的结构简式:(C6H10O5)n难度: 简单查看答案及解析
-
下列有关物质的性质与用途具有对应关系的是
A. Na2S具有还原性,可用于去除水体中Hg2+
B. 乙醇具有氧化性,75%乙醇溶液常用于医疗消毒
C. 葡萄糖易溶于水,可用作制镜工业的原料
D. 油脂能在碱性条件下水解,可用于工业上制取肥皂
难度: 简单查看答案及解析
-
短周期主族元素X、Y、Z、W原子序数依次增大。X元素的最高价氧化物对应的水化物与其气态氢化物相遇会有白烟,Y是同周期中原子半径最小的主族元素,Z原子的最外层电子数与最内层电子数相同,W与Y同主族。下列说法正确的是
A. 原子半径:r(X)<r(Z)<r(W)
B. X的简单气态氢化物的热稳定性比Y的弱
C. Y分别与X和Z形成的化合物所含化学键类型相同
D. W的氧化物的水化物一定是强酸
难度: 中等查看答案及解析
-
在给定条件下,下列选项中所示的物质间转化均能实现的是
A. Al(OH)3
AlCl3(aq)
Al
B. AgNO3(aq)
[Ag(NH3)2]OH(aq)
Ag
C. 淀粉溶液
葡萄糖
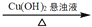 Cu2O
Cu2OD. 石油
C2H4

难度: 中等查看答案及解析
-
下列实验方案不能达到目的的是
A. 用裂化汽油萃取碘水中的碘
B. 用水鉴别苯、四氯化碳、乙醇三种无色液体
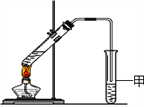
C. 用如图装置验证Na和水反应是否为放热反应
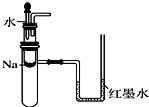
D. 往酸性KMnO4溶液中加入乙醇,验证乙醇的还原性
难度: 中等查看答案及解析
-
在下列变化过程中,既有离子键被破坏又有共价键被破坏的是
A. 烧碱熔化 B. 硫酸氢钠溶于水
C. 将HCl通入水中 D. 溴蒸汽被木炭吸附
难度: 中等查看答案及解析
-
X、Y、Z、M、N代表五种金属,有以下化学反应:①水溶液中:X + Y2+=X2+ + Y;②Z + 2H2O(冷)=Z(OH)2 + H2↑; ③Y可以溶于稀H2SO4中,M不被稀H2SO4氧化;④M、N为电极与N盐溶液组成原电池,发生的电极反应为:M-2e-=M2+。则这五种金属的活泼性由弱到强的顺序是
A. M<N<Y<X<Z B. N<M<X<Y<Z
C. N<M<Y<X<Z D. X<Z<N<M<Y
难度: 中等查看答案及解析
-
有一类有机硅化物叫硅烷,它的分子组成与烷烃相似。下列有关说法中不正确的是
A. 硅烷的分子组成通式可表示为SinH2n+2
B. 甲硅烷(SiH4)完全燃烧生成二氧化硅和水
C. 相同条件下,甲硅烷(SiH4)的密度大于甲烷
D. 甲硅烷(SiH4)的热稳定性强于甲烷
难度: 中等查看答案及解析
-
下列关于资源综合利用和环境保护的化学方程式与工业生产实际不相符的是
A. 海水提溴时用SO2吸收Br2蒸气:SO2 + Br2 + 2H2O=H2SO4 + 2HBr
B. 将煤气化为可燃性气体:C(s) + H2O(g)
CO(g) + H2(g)
C. 用电解法从海水中提取镁:2MgO(熔融)
2Mg + O2↑
D. 燃煤时加入CaCO3脱硫:2CaCO3 + 2SO2 + O2
2CaSO4 + 2CO2
难度: 中等查看答案及解析
-
莽草酸可用于合成药物达菲,其结构简式如图。下列关于莽草酸的说法正确的是
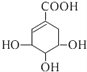
A. 莽草酸分子式为C7H10O
B. 莽草酸分子中含有两种官能团
C. 一定条件下莽草酸可发生取代、加成、氧化反应
D. 1mol莽草酸最多能和4mol NaOH发生中和反应
难度: 中等查看答案及解析
-
根据下列实验操作和现象所得到的结论正确的是
选项
操作和现象
结论
A
向硅酸钠溶液中通入SO2气体,溶液变浑浊
非金属性:S>Si
B
将石蜡油蒸气通过炽热的碎瓷片分解,得到的气体通入酸性KMnO4溶液,溶液褪色
分解产物中含乙烯
C
向20%蔗糖溶液中加入少量稀H2SO4,加热,再加入银氨溶液,未出现银镜
蔗糖未水解
D
取5mL 0.1mol·L-1KI溶液,滴加5滴0.1mol·L-1FeCl3溶液,振荡,再加入5mLCCl4,振荡,静置,取上层液体,向其中滴加KSCN溶液,显血红色
KI和FeCl3反应有一定的限度
A. A B. B C. C D. D
难度: 中等查看答案及解析