-
在甲、乙两烧杯溶液中,分别含有大量的Cu2+、K+、H+、Cl-、CO32-、OH-6种离子中的3种,已知甲烧杯的溶液呈蓝色,则乙烧杯的溶液中大量存在的离子是( )
A.Cu2+、H+、Cl-
B.CO32-、OH-、Cl-
C.K+、H+、Cl-
D.K+、OH-、CO32-难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.运用电化学原理可以进行金属防护
B.氢氧化铝、碳酸钙、醋酸铅都可作抗酸药
C.使用太阳能代替化石燃料,能减少温室气体的排放
D.“酸雨”主要是由大气中含有较高浓度的硫和氮的氧化物造成的难度: 中等查看答案及解析
-
下列化学用语的表述不正确的是( )
A.过氧化氢的结构式:H-O-O-H
B.2,2-二甲基丁烷的实验式:C3H7
C.质子数与中子数相等的氢原子符号:H
D.Cl-的结构示意图: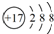
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.1 mol OH-中含有电子数是9×6.02×1023
B.1 L 1 mol•L-1 FeCl3溶液中含有铁离子数是6.02×1023
C.标准状况下,22.4 L氢气和氧气的混合气体中,分子总数是6.02×1023
D.1 mol Cu和足量稀HNO3反应生成NO气体,转移电子数是3×6.02×1023难度: 中等查看答案及解析
-
下列说法正确的是( )
A.天然油脂的分子中含有酯基,属于酯类
B.煤经处理变为气体燃料的过程属于物理变化
C.Al2O3可以与水反应得到其对应水化物Al(OH)3
D.可以用加热使蛋白质变性的方法分离提纯蛋白质难度: 中等查看答案及解析
-
下列顺序不正确的是( )
A.热稳定性:HF>HCl>HBr>HI
B.微粒的半径:Cl->Na+>Mg2+>Al3+
C.电离程度(同温度同浓度溶液中):HCl>CH3COOH>NaHCO3
D.分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液难度: 中等查看答案及解析
-
下列说法正确的是( )
A.含有离子键和共价键的化合物一定是离子化合物
B.元素原子的最外层电子数等于该元素的最高化合价
C.目前人们已发现的元素种类数目与原子种类数目相同
D.多电子原子钟,在离核较近的区域内运动的电子能量较高难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A.小苏打溶液中加入少量石灰水:HCO+Ca2++OH-=CaCO3↓+H2O
B.稀硝酸中加入过量铁粉:Fe+4H++NO=Fe3++NO↑+2H2O
C.溴化亚铁溶液中通入足量氯气:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
D.苯酚钠溶液中通入少量二氧化碳:难度: 中等查看答案及解析
-
关于常温下pH=12的NaOH溶液,下列说法错误的是( )
A.c(OH-)=c(Na+)+c(H+)
B.由水电离出的c(OH-)=1.0×10-12mol•L-1
C.与等体积pH=2的醋酸混合后所得溶液显碱性
D.与等体积0.01 mol•L-1氯化铵溶液混合后所得溶液中:c(Na+)>c(NH)
难度: 中等查看答案及解析
-
室温条件下进行下列各组实验,其中的观察要点不能说明醋酸是弱电解质的是( )
选项 实验方案 观察要点 A 等浓度的醋酸与氢氧化钠溶液反应 恰好反应时的体积比 B 醋酸溶液中加入醋酸钠固体 溶液pH的变化 C 等体积等浓度的盐酸和醋酸分别和等量镁条反应 产生H2的起始速率 D 将pH=4的醋酸稀释成pH=6的溶液 加H2O的量
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
将SO2分别通入下列4种溶液中,有关说法正确的是( )
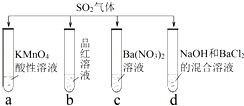
A.试管a中实验可以证明SO2具有漂白性
B.试管b中溶液褪色,说明SO2具有强氧化性
C.试管c中能产生白色沉淀,说明SO2具有还原性
D.试管d中能产生白色沉淀,该沉淀完全溶于稀硝酸难度: 中等查看答案及解析
-
碘与氢气反应的热化学方程式是
①I2(g)+H2(g)⇌2HI(g)△H=-9.48kJ•mol-1
②I2(s)+H2(g)⇌2HI(g)△H=+26.48kJ•mol-1
下列说法正确的是( )
A.①的产物比②的产物稳定
B.I2(s)=I2(g)△H=+17.00 kJ•mol-1
C.②的反应物总能量比①的反应物总能量低
D.1mol I2(g)中通入1 mol H2(g),发生反应时放热9.48 kJ难度: 中等查看答案及解析
-
用选项中的电极、溶液和如图所示装置可组成原电池.下列现象或结论的叙述正确的是( )
选项 电极a 电极b A溶液 B溶液 现象或结论 A Cu Zn CuSO4 ZnSO4 一段时间后,a增加的质量与b减少的质量相等 B Cu Zn 稀H2SO4 ZnSO4 盐桥中阳离子向b极移动 C Fe C NaCl FeCl3 外电路电子转移方向:b→a D C C FeCl3 KI、淀粉混合液 若开始时只增大FeCl3溶液浓度,b极附近
溶液变蓝的速度加快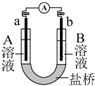
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
在容积恒定的密闭容器中,一定量的SO2与1.1mol O2发生反应:2SO2(g)+O2(g)
2SO3(g)△H<0.当气体的物质的量减少0.315mol时,反应达到平衡,SO2的平衡转化率是90%.下列说法正确的是( )
A.相同条件下,平衡时若充入稀有气体,SO2的转化率增大
B.反应开始时,向容器中通入的SO2的物质的量是0.7 mol
C.保持其他条件不变,仅降低温度,正反应速率减小程度比逆反应速率减小程度大
D.保持其他条件不变,仅缩小容器体积,反应达到平衡时容器中有1.485 mol气体难度: 中等查看答案及解析
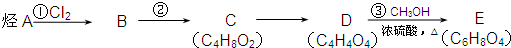
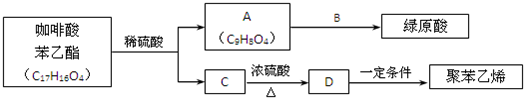
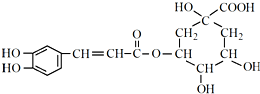 )是一种抗氧化药物,存在如图转化关系.
)是一种抗氧化药物,存在如图转化关系.