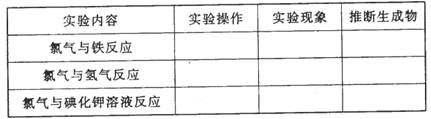
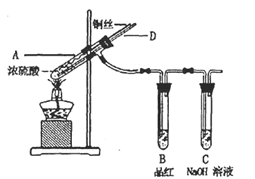
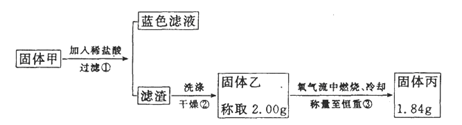
-
下列说法正确的是 ( )
A.铜、石墨均能导电,所以它们均是电解质
B.NH3、CO2的水溶液均能导电,所以NH3、CO2均是电解质
C.液态、HCl、固体NaCl均不能导电,所以HCl、NaCl均是非电解质
D.蔗糖、酒精在水溶液或熔融状态下均不能导电,所以它们均是非电解质
-
按照物质的树状分类和交叉分类,HNO3应属于:①酸 ②氢化物 ③氧化物 ④含氧酸 ⑤一元酸 ⑥强酸 ⑦化合物 ⑧有机物 ⑨无机化合物
A.①④⑤⑥⑦⑨ B.①②③④⑤⑥⑦⑨ C.①②④⑧ D.①④⑤⑥
-
某固体物质只含有钠和氧两种元素,将它放在足量的水中产生两种气体,这两种气体又可以在一定条件下反应生成水。则原固体物质的组成是 ( )
A.Na2O2与Na2O B.Na和NaOH C.Na2O2和Na D.Na和Na2O
-
下列有关物质的性质和该性质的应用均正确的是 ( )
A.常温下浓硫酸是铝发生钝化,可在常温下用铝制贮藏贮运浓硫酸
B.二氧化硅不与任何酸反应,可用石英制造耐酸容器
C.氯气具有还原性,可用于自来水的杀菌消毒
D.铜的金属活泼性比铁的差,可在海轮外壳上装若干铜块以减缓其腐蚀
-
配制一定物质的量浓度的NaOH溶液时,下列哪个原因会造成所配溶液浓度偏高 ( )
A.所用NaOH已 经潮解 B.向容量瓶中加水未到刻度线
C.有少量NaOH溶液残留在烧杯里 D.称量时误用“左码右物”
-
氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂等。下列反应与2Al+2NaOH+2H2O=2NaAlO2+3H2↑相比较,水的作用相同的是 ( )
A.2Na2O2+2H2O=4NaOH+O2↑
B.4Fe(OH)2+O2+2H2O=4Fe(OH)3
C.2Na+2H2O=2NaOH+H2↑
D.2F2+2H2O=4HF+O2
-
常温下,下列各组离子在指定溶液中一定能大量共存的是 ( )
A.1.0mol·L-1的KNO3溶液:H+、Fe2+、Cl—、SO2—4
B.甲基橙呈红色的溶液:NH+4、Ba2+、AlO—2、Cl—
C.pH=12的溶液:K+、Na+、CH3COO—、Br—
D.含有大量Fe3+的溶液中:NH+4、Na+、Cl—、SCN—
-
今有甲、乙、丙三瓶等体积的新制氯水,浓度均为0.1mol·L-1。如果在甲瓶中加入少量的NaHCO3晶体(m mol),在乙瓶中加入少量的NaHSO3晶体(m mol),丙瓶不变。片刻后,甲、乙、丙三瓶溶液中的HClO的物质的量浓度的大小关系是(溶液体积变化忽略不计) ( )
A.甲=乙>丙 B.甲>丙>乙 C.丙>甲=乙 D.乙>丙>甲
-
下列表示对应化学反应的离子方程式正确的是 ( )
A.Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O
B.硫化亚铁溶于稀硝酸中:FeS+2H+=Fe2++H2S↑
C.NH4HCO3溶于过量的NaOH溶液中:HCO—3+OH—=CO2-3+H2O
D.向氯化铝溶液中加入过量氢氧化钠溶液:Al3++4OH—=AlO—2+2H2O
-
下列叙述正确的是 ( )
A.1.00 mol NaCl中含有6.02×1023个NaCl分子
B.1 mol Cl2与足量的铁反应,转移的电子数为3NA
C.1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子
D.1.00molNaCl中,所有Na+的最外层电子总数为10×6.02×1023
-
过滤后的食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4等杂质,通过如下几个实验步骤,可制得纯净的食盐水:①加入稍过量的Na2CO3溶液;②加入稍过量的NaOH溶液;③加入稍过量的BaCl2溶液;④滴入稀盐酸至无气泡产生;⑤过滤正确的操作顺序是( )
A.③②①⑤④ B.①②③⑤④ C.②③①④⑤ D.③⑤②①④
-
欲配制100mL 1.0mol·L-1Na2SO4溶液,正确的方法是 ( )
①将14.2g Na2SO4溶于100mL水中
②将32.2gNa2SO4·10H2O溶于少量水 中,再用水稀释至100mL
③将20mL 5.0mol·L-1Na2SO4溶液用水稀释至100mL
④将20mL 5.0mol·L-1Na2SO4溶液用水稀释至100mL
A.①② B.②③ C.①③ D.①②③
-
下列现象或事实可用同一原理解释的是 ( )
A.浓硫酸和浓盐酸长期暴露在空气中浓度降低
B.SO2、漂白粉、活性炭、过氧化钠都能使红墨水褪色,其原理相同
C.漂白粉和水玻璃长期暴露在空气中变质
D.能使品红溶液褪色的气体不一定是SO2
-
某混合气体中可能含有Cl2、O2、SO2、NO、NO2中的两种或多种气体。现将此无色混合气体通过品红溶液后,品红溶液褪色,把剩余气体排入空气中,很快变为红棕色。对于原混合气体成分的判断中正确的是 ( )
A.肯定有SO2,但无NO B.肯定没有Cl2、O2和NO2
C.可能有Cl2和O2 D.肯定只有NO
-
甲、乙、丙、丁四种易溶于水的物质,分别由NH+4、Ba2+、Mg2+、H+、OH—、Cl—、HCO—3、SO2-4中的不同阳离子和阴离子各一种组成,已知:①将甲溶液分别与其它三种物质的溶液混合,均有白色沉淀生成;②0.1mol·L-1乙溶液中c(H+)>0.1mol·L-1;③向丙溶液中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成。下列结论不正确的是( )
A.甲溶液含有Ba2+ B.乙溶液含有SO2-4
C.丙溶液含有Cl— D.丁溶液含有Mg2+
-
赤铜矿的主要成分是Cu2O,辉铜矿的主要成分是Cu2S,将赤铜矿与辉铜矿混合加热发生以下反应:Cu2S+2Cu2O=6Cu+SO2↑,关于该反应的说法中,正确的是( )
A.该反应的氧化剂只有Cu2O
B.Cu2S在反应中既是氧化剂,又是还原剂
C.Cu既是氧化产物又是还原产物
D.每生成19.2g Cu,反应中转移1.8mol电子
-
铜、镁合金4.6g完全溶于浓硝酸,若反应中硝酸被原只产生4 480mL的NO2气体和336mL 的N2O4气体(均为标准状况下),在反应后的溶液中加入足量的NaOH溶液,生成的沉淀的质量为 ( )
A.7.04g B.8.26g C.8.51g D.9.02g