-
(本题16分)Ⅰ。某实验小组同学为了探究铜与浓硫酸的反应,进行了如下系列实验。
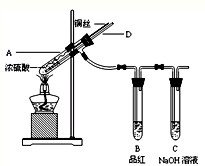
【实验1】铜与浓硫酸反应,实验装置如图所示。
实验步骤:
①先连接好装置,检验气密性,加入试剂;
②加热A试管直到B中品红褪色,熄灭酒精灯;
③将Cu丝上提离开液面。
(1)装置A中发生反应的化学方程式为 。
(2)熄灭酒精灯后,因为有导管D的存在,B中的液体不会倒吸,其原因是 。
(3)拆除装置前,不需打开胶塞,就可使装置中残留气体完全被吸收,应当采取的操作是 。
Ⅱ。饱和的NaHSO3溶液可以与醛发生加成反应,生成水溶性的α-羟基磺酸钠。发生的反应为:
R-CHO + NaHSO3  R-CH(OH)SO3Na
R-CH(OH)SO3Na
反应是可逆的,在通常条件下有70%--90%向正反应方向转化。
(4)利用Ⅰ中装置制取少量NaHSO3溶液,应采取措施,将装置进行部分改变。这种措施是:_____________________________________________________________________;确认有NaHSO3生成的现象是:_______________________________________.
(5)若溴苯中混有杂质乙醛,欲将此杂质除去,可采用的试剂是:__________,其分离的方法是:_____________________.
(6)若在CH3-CH(OH)SO3Na 水溶液中加入足量盐酸,有机物转化为:___________,将该转化产物分离出来的方法常用__________________.
-
(14分)某实验小组同学为了探究铜与浓硫酸的反应,进行了如下系列实验。
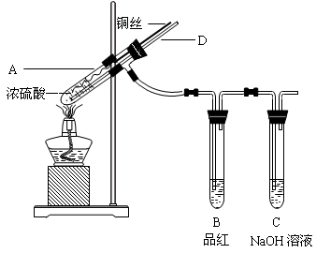
【实验1】铜与浓硫酸反应,实验装置如图所示。
实验步骤:
①先连接好装置,检验气密性,加入试剂;
②加热A试管直到B中品红褪色,熄灭酒精灯;
③将Cu丝上提离开液面。
(1)装置A中发生反应的化学方程式为 。
(2)熄灭酒精灯后,因为有导管D的存在,B中的液体不会倒吸,其原因是 。
(3)拆除装置前,不需打开胶塞,就可使装置中残留气体完全被吸收,应当采取的操作是 。
【实验2】实验中发现试管内除了产生白色固体外,在铜丝表面还产生黑色固体甲,其中可能含有氧化铜、硫化铜、硫化亚铜,以及被掩蔽的氧化亚铜。
查阅资料:
①氧化亚铜在酸性环境下会发生自身氧化还原反应生成Cu2+和铜单质,在氧气流中煅烧,可以转化为氧化铜。
②硫化铜和硫化亚铜常温下都不溶于稀盐酸,在氧气流中煅烧,硫化铜和硫化亚铜都转化为氧化铜和二氧化硫。
为了研究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如图的实验:

(4)②中检验滤渣是否洗涤干净的实验方法是 。
(5)③中在煅烧过程中一定发生的反应的化学方程式为 。
(6)下列对于固体甲的成分的判断中,正确的是(填字母选项) 。
A.固体甲中,CuS和Cu2S不能同时存在
B.固体甲中,CuO和Cu2O至少有一种
C.固体甲中若没有Cu2O,则一定有Cu2S
D.固体甲中若存在Cu2O,也可能有Cu2S
-
(14分)某实验小组同学为了探究铜与浓硫酸的反应,进行了如下系列实验。
[实验1]铜与浓硫酸反应,实验装置如图所示。

实验步骤:
①先连接好装置,检验气密性,加入试剂;
②加热A试管直到B中品红褪色,熄灭酒精灯;
③将Cu丝上提离开液面。
(1)装置A中发生反应的化学方程式为 。
(2)熄灭酒精灯后,因为有导管D的存在,B中的液体不会倒吸,其原因是 。
(3)拆除装置前,不需打开胶塞,就可使装置中残留气体完全被吸收,应当采取的操作是 ________。
[实验2]实验中发现试管内除了产生白色固体外,在铜丝表面还产生黑色固体甲,其中可能含有氧化铜、硫化铜、硫化亚铜,以及被掩蔽的氧化亚铜。
查阅资料:
①氧化亚铜在酸性环境下会发生自身氧化还原反应生成Cu2+和铜单质,在氧气流中煅烧,可以转化为氧化铜。
②硫化铜和硫化亚铜常温下都不溶于稀盐酸,在氧气流中煅烧,硫化铜和硫化亚铜都转化为氧化铜和二氧化硫。
为了研究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如图的实验:

(4)②中检验滤渣是否洗涤干净的实验方法是 ________
(5)③中在煅烧过程中一定发生的反应的化学方程式为 ________。
(6)下列对于固体甲的成分的判断中,正确的是(填字母选项) 。
A.固体甲中,CuS和Cu2S不能同时存在
B.固体甲中,CuO和Cu2O至少有一种
C.固体甲中若没有Cu2O,则一定有Cu2S
D.固体甲中若存在Cu2O,也可能有Cu2S
-
某实验小组同学为了探究铜与浓硫酸的反应,进行了如下系列实验。
【实验1】铜与浓硫酸反应,实验装置如图20所示。

实验步骤:
①先连接好装置,检验气密性,加入试剂;
②加热A试管直到B中品红褪色,熄灭酒精灯;
③将Cu丝上提离开液面。
(1)装置A中发生反应的化学方程式为____。
(2)熄灭酒精灯后,因为有导管D的存在,B中的液体不会倒吸,其原因是________。
(3)拆除装置前,不需打开胶塞,就可使装置中残留气体完全被吸收,应当采取的操作是________。
【实验2】实验中发现试管内除了产生白色固体外,在铜丝表面还产生黑色固体甲,其中可能含有氧化铜、硫化铜、硫化亚铜,以及被掩蔽的氧化亚铜。
查阅资料:
①氧化亚铜在酸性环境下会发生自身氧化还原反应,生成Cu2+和铜单质。在氧气流中煅烧,可以转化为氧化铜。
②硫化铜和硫化亚铜常温下都不溶于盐酸。在氧气流中煅烧,硫化铜和硫化亚铜都转化为氧化铜和二氧化硫。
为了研究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如图21的实验:
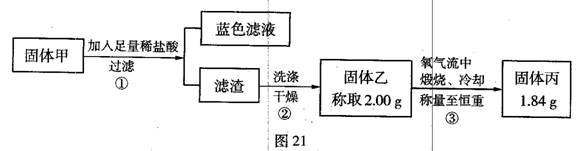
(4)②中检验滤渣是否洗涤干净的实验方法是________。
(5)③中在煅烧过程中一定发生的反应的化学方程式为________。
(6)下列对于固体甲的成分的判断中,正确的是(填字母选项)________。
A.固体甲中,CuS和Cu2S不能同时存在
B.固体甲中,CuO和Cu2O至少有一种
C.固体甲中若没有Cu2O,则一定有Cu2S
D.固体甲中若存在Cu2O,也可能有Cu2S
-
某实验小组同学为了探究铜与浓硫酸的反应,进行了如下系列实验。
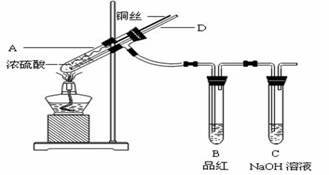
【实验1】铜与浓硫酸反应,实验装置如图所示。
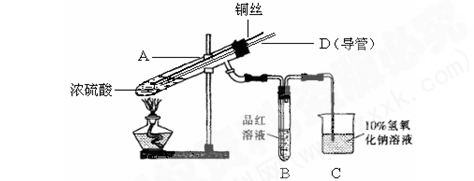
实验步骤:
①先连接好装置,检验气密性,加入试剂;
②加热A试管直到B中品红褪色,熄灭酒精灯;
③将Cu丝上提离开液面。
(1)装置A中发生反应的化学方程式为____。
(2)熄灭酒精灯后,因为有导管D的存在,B中的液体不会倒吸,其原因是________。
(3)拆除装置前,不需打开胶塞,就可使装置中残留气体完全被吸收,应当采取的操作是________。
【实验2】实验中发现试管内除了产生白色固体外,在铜丝表面还产生黑色固体甲,其中可能含有氧化铜、硫化铜、硫化亚铜,以及被掩蔽的氧化亚铜。
查阅资料:
①氧化亚铜在酸性环境下会发生自身氧化还原反应,生成Cu2+和铜单质。在氧气流中煅烧,可以转化为氧化铜。
②硫化铜和硫化亚铜常温下都不溶于盐酸。在氧气流中煅烧,硫化铜和硫化亚铜都转化为氧化铜和二氧化硫。
为了研究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如图的实验:
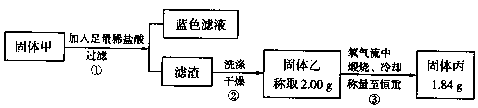
(4)②中检验滤渣是否洗涤干净的实验方法是________。
(5)③中在煅烧过程中一定发生的反应的化学方程式为________。
(6)下列对于固体甲的成分的判断中,正确的是(填字母选项)________。
A.固体甲中,CuS和Cu2S不能同时存在
B.固体甲中,CuO和Cu2O至少有一种
C.固体甲中若没有Cu2O,则一定有Cu2S
D.固体甲中若存在Cu2O,也可能有Cu2S
-
Ⅰ、某实验小组同学为了探究铜与浓硫酸的反应,进行了如下系列实验,实验装置如图所示:
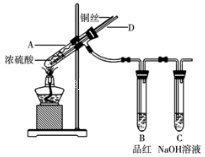
实验步骤:①先连接好装置,检验气密性,加入试剂;②加热A试管直到B中品红褪色,熄灭酒精灯;③将Cu丝上提离开液面。
(1)装置A中发生反应时,浓硫酸表现出的性质是________。
(2)若将B中品红溶液换成酸性高锰酸钾溶液,A中反应一段时间后,用离子方程式解释酸性高锰酸钾溶液褪色的原因:_________。
(3)导管D在实验安全和实验环保方面都有重要意义。
其中,安全方面是指在酒精灯熄灭后能够______________________________;环保方面是指可以在拆除装置前,不需打开胶塞,采取适当的简单操作就可使装置中残留少量SO2气体完全被吸收,其操作是________。
Ⅱ、以一定比例的浓硫酸、浓硝酸溶解粗铜,再补充水和空气为原料,即可制得硫酸铜晶体。其过程如下图所示。
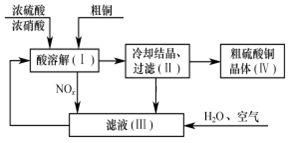
(4)过程(I)中浓硫酸和浓硝酸表现出的性质分别是_________。
(5)用NOx具体的分子是表示在滤液(Ⅲ)中反应的化学方程式:______。
(6)上述生产过程中___________(填化学式)可以循环使用,体现出该流程具有一定的绿色化学理念。
(7)写出制取硫酸铜的总反应方程式__________。
-
(16分)Ⅰ、某实验小组同学为了探究铜与浓硫酸的反应,进行了如下系列实验,实验装置如图所示:
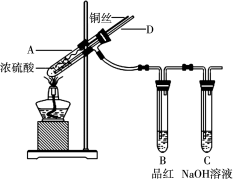
实验步骤:①先连接好装置,检验气密性,加入试剂;②加热A试管直到B中品红褪色,熄灭酒精灯;
③将Cu丝上提离开液面。
(1)装置A中发生反应的化学方程式为 。
(2)拆除装置前,不需打开胶塞,就可使装置中残留气体完全被吸收,应当采取的操作是 。
(3)若将B中品红溶液换成溴水,通入一段时间后溴水褪色,这说明了二氧化硫具有漂白性,你是否同意这个观点 ,(填“同意”或“不同意”),说明理由 (用离子方程式表示)。
Ⅱ、以浓硫酸、浓硝酸、粗铜、水和空气为原料可制得硫酸铜晶体。其过程如下图所示。
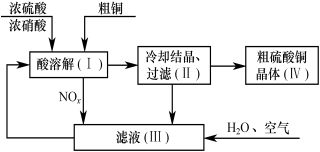
回答下列问题:
(4)配平在滤液(Ⅲ)中发生反应的化学方程式:
NOx+ H2O+ O2= HNO3
(5)写出制取硫酸铜的总反应方程式: 。
(6)在上述生产过程中,被循环使用的物质是 。
-
Ⅰ、某实验小组同学为了探究铜与浓硫酸的反应,进行了如下系列实验,实验装置如图所示:
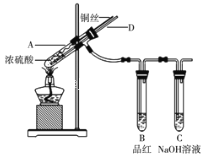
实验步骤:①先连接好装置,检验气密性,加入试剂;②加热A试管直到B中品红褪色,熄灭酒精灯;③将Cu丝上提离开液面。
(1)装置A中发生反应时,浓硫酸表现出的性质是________。
(2)若将B中品红溶液换成酸性高锰酸钾溶液,A中反应一段时间后,用离子方程式解释酸性高锰酸钾溶液褪色的原因:_________。
(3)导管D在实验安全和实验环保方面都有重要意义。
其中,安全方面是指在酒精灯熄灭后能够______________________________;环保方面是指可以在拆除装置前,不需打开胶塞,采取适当的简单操作就可使装置中残留少量SO2气体完全被吸收,其操作是________。
Ⅱ、以一定比例的浓硫酸、浓硝酸溶解粗铜,再补充水和空气为原料,即可制得硫酸铜晶体。其过程如下图所示。
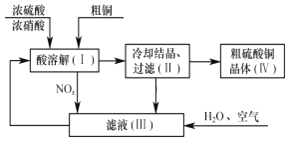
(4)过程(I)中浓硫酸和浓硝酸表现出的性质分别是_________。
(5)用NOx具体的分子是表示在滤液(Ⅲ)中反应的化学方程式:______。
(6)上述生产过程中___________(填化学式)可以循环使用,体现出该流程具有一定的绿色化学理念。
(7)写出制取硫酸铜的总反应方程式__________。
-
(14分)某实验小组同学为了探究铜与浓硫酸的反应,进行了如下系列实验。
【实验1】铜与浓硫酸反应,实验装置如下图所示。
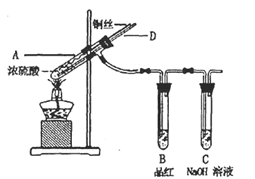
实验步骤:
①先连接好装置,检验气密性,加入试剂;
②加热A试管直到B中品红褪色,熄灭酒精灯;
③将Cu丝上提离开液面。
(1)装置A中发生反应的化学方程式为________。
装置C中发生反应的离子方程式为________。
(2)熄灭酒精灯后,因为有导管D的存在,B中的液体不会倒吸,其原因是________。
(3)拆除装置前,不需打开胶塞,就可使装置中残留气体完全被吸收,应当采取的操作是
________。
【实验2】实验中发现试管内除了产生白色固体外,在铜丝表面还产生黑色固体甲,其中可能含有氧化铜、硫化铜、硫化亚铜,以及被掩蔽的氧化亚铜。
查阅资料:
①氧化亚铜在酸性环境下会发生自身氧化还原反应生成Cu2+和铜单质,在氧气流中煅烧,可以转化为氧化铜。
②硫化铜和硫化亚铜常温下都不溶于稀盐酸,在氧气流中煅烧,硫化铜和硫化亚铜都转化为氧化铜和二氧化硫。为了研究甲的成分,该小组同学在收集到足够量的固体甲后,进行如下图的实验:
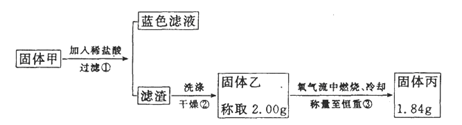
(4)②中检验滤渣是否洗涤干净的实验方法是________。
(5)③中在煅烧过程中一定发生的反应的化学方程式为________。
(6)下列对于固体甲的成分的判断中,不正确的是(填字母选项)。
A.固体甲中,CuS和Cu2S不能同时存在
B.固体甲中,CuO和Cu2O至少有一种
C.固体甲中若没有Cu2O,则一定有Cu2S
D.固体甲中若存在Cu2O,也可能有Cu2S
-
某实验小组同学为了探究铜与浓硫酸的反应,进行如下实验.
实验1:铜与浓硫酸反应,实验装置如图所示.
实验步骤:
①先连接好装置,检验气密性,加入试剂;
②加热A试管直到B中品红褪色,熄灭酒精灯;
③将Cu丝上提离开液面.
(1)装置A中发生反应的化学方程式为______ CuSO4+SO2↑+2H2O