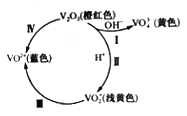
-
化学与生活、社会、环境等密切相关。下列有关说法正确的是
A. 棉、丝、毛、油脂都是天然有机高分子化合物
B. 天然气作为化工原料可用于合成氨和生产甲醇
C. 酒是厨房中常见物质,其有效成分为CH3COOH
D. 为了增加食物的营养成分,可以大量使用视频添加剂
难度: 简单查看答案及解析
-
设NA为阿伏伽德罗常数的值,下列说法正确的是
A. 17g H2S中所含的电子数为9NA
B. 9g H2O 中所含H-O键数为2NA
C. 0.1mol CO2和2.24L CO 中所含碳原子数均为0.1NA
D. 0.3mol NO2与足量水充分反应,生成H+数目为0.3NA
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A. 用NaOH溶液吸收Cl2:Cl2 +2OH- = 2Cl- + H2O
B. Fe2(SO4)3和Ba(OH)2溶液混合 :Fe3++3OH-=Fe(OH)3↓
C. 向AgCl悬浊液中加入Na2S溶液 :2AgCl+S2-=Ag2S+2Cl-
D. 向NaHCO3溶液中加入澄清石灰水 :HCO3-+OH-=CO32-+H2O
难度: 中等查看答案及解析
-
下列有关有机物的叙述不正确的是
A. 甲烷、乙醇、乙酸和酯类都可以发生取代反应
B. 乙烯和苯都能使溴水褪色,但颜色的原因不同
C. 石油催化裂化的主要目的是提高芳香烃的产量
D. 纤维素和蛋白质都是能发生水解反应的高分子化合物
难度: 中等查看答案及解析
-
以KI为碘剂的加碘食盐,由于受空气作用,容易引起碘的损失,工业生产中需添加稳定剂以减少碘的损失。下列物质中可能做稳定剂的是
A. Na2S2O3 B. FeCl3 C. NaHCO3 D. CaO
难度: 中等查看答案及解析
-
甲、乙、丙、丁为四种主族元素,已知甲与乙、丙、丁三元素相邻;甲、乙的原子序数之和等于丙的原子序数,四种元素原子的最外层电子数之和为20。下列判断中,正确的是
A. 原子半径:丙>乙>甲 B. 最外层电子数:丙=丁
C. 气态氢化物的稳定性:甲>丙 D. 最高价氧化物对应的水化物的酸性:丁>甲
难度: 中等查看答案及解析
-
下列根据实验操作和现象所得出的结论正确的是
选 项
实验操作
实验现象
结 论
A
向NaHS溶液中滴入酚酞
溶液变红色
HS-水解程度大于电离程度
B
向浓度均为0.1 mol·L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水
先出现蓝色沉淀
Ksp[Mg(OH)2]<Ksp[Cu(OH)2]
C
向Na2CO3溶液中加入浓盐酸,将产生的气体通入苯酚钠溶液中
产生白色浑浊
酸性:盐酸>碳酸>苯酚
D
向盛有KI3溶液的两试管中分别加入淀粉溶液和AgNO3溶液
前者溶液变蓝色,后者有黄色沉淀
KI3溶液中存在
I2+
平衡
难度: 简单查看答案及解析