-
下列说法不正确的是
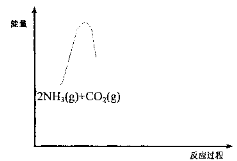
A.合成氨反应在低温下能够自发进行,是因为反应物键能之和大于生成物键能之和
B.元素分析仪可以确定物质中是否含有C、H、O、N、S、Cl、Br等元素,原子吸收光谱可以确定物质中含有哪些金属元素
C.人们利用元素周期律在过渡元素中寻找各种性能优良的催化剂,以降低化学反应的活化能,从而起到很好的节能效果
D.超高分辨率荧光显微镜能够观察到纳米尺度的物质,用它可以获得蛋白质溶液中的分子图像
难度: 中等查看答案及解析
-
下列说法不正确的是
A.在粗盐提纯中,当加热到蒸发皿中有较多固体析出,残留少量液体时,停止加热, 用余热将液体蒸干
B.当振荡分液漏斗中的混合溶液时,须用一只手压住分液漏斗的玻璃塞,另一只手握住旋塞,将分液漏斗倒转过来,用力振荡
C.从加碘盐中获取碘单质的操作步骤为:溶解—萃取—分液—蒸馏
D.实验过程中若皮肤不慎沾上少量碱液,应先用大量水冲洗,再用2%醋酸溶液或饱和硼酸溶液洗,最后用水冲洗
难度: 简单查看答案及解析
-
短周期元素X、Y、Z、W、M的原子序数依次增大,X、Z同主族,Z、W、M同周期,其中X 与Y能形成两种物质,且常温下均为液体。W的氧化物既能溶于强碱溶液,又能溶于X、M形成的水溶液。已知W与M形成的物质在178°C时升华。下列说法不正确的是
A.Z、W、M的原子半径由大到小的顺序为Z>W>M
B.M分别与Z、W所形成的物质的晶体类型相同
C.X2Y2易溶于X2Y中,是由于X2Y2与X2Y能形成分子间氢键
D.将Z2Y在空气中加热可得到Z2Y2
难度: 中等查看答案及解析
-
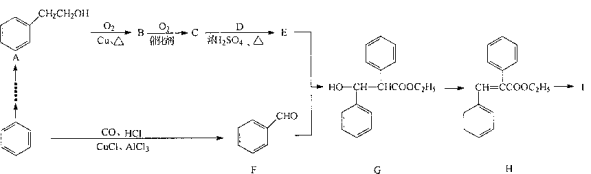
下列说法正确的是
A.按系统命名法,化合物
的名称为2-甲基-3-乙基丁烷
B.甲醇、乙醇、甘油互为同系物
C.等物质的量的乙炔、乙醛、
完全燃烧时耗氧量不相等
D.以乙烯为原料制备乙酸乙酯的合成路线可以为:
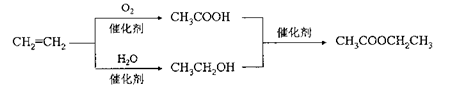
难度: 困难查看答案及解析
-
化学镀铜废液中含有一定量的CuSO4,任意排放会污染环境,利用电化学原理可对废液进行回收处理,装置如图,其中质子交换膜只允许H+通过。已知:①Cu2+ + HCHO + 3OH-=Cu + HCOO-+ 2H2O;②还原性:HCHO > M(—种金属)> Cu。
下列说法正确的是
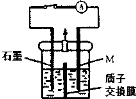
A.反应之前,应将含OH-的HCHO溶液加人到装置的左侧
B.右侧发生的电极反应式:HCHO-2e-+ H2O = HCOO- + 3H+
C.若将质子交换膜换成阴离子交换膜,放电过程中,大量的OH-将向左侧迁移
D.放电一段时间后打开开关,移去质子交换膜,装置中可能会有红色固体、蓝色絮状物出现
难度: 困难查看答案及解析
-
在25°C时,向10mL 0.0lmol· L-1NaCN溶液中逐滴加人0.0lmol·L-1的盐酸,滴定曲线如图1所示,CN—、HCN浓度所占分数(α)随pH变化的关系如图2所示,下列表 述正确的是
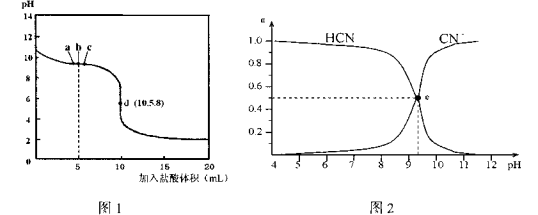
A.b点时,溶液中微粒浓度大小的关系:c(CN-)>c(Cl-)>c(HCN)>c<(OH-)>c(H+)
B.d 点溶液存在的关系:c(Na+) + c(H+) = c(HCN) + c(OH-) + 2c(CN-)
C.图2中的e点对应图1中的c点
D.在滴定过程中选用酚酞试剂比选用甲基橙试剂作指示剂误差更小
难度: 困难查看答案及解析
-
某溶液中可能含有Na+、K+、AlO2-、CO32-、SO32-、Cl-中的若干种离子。某同学设计并完成了如下实验:
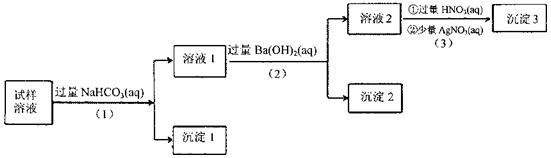
已知:AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-
根据以上的实验操作与现象,该同学得出的结论不正确的是
A.沉淀2放置在空气中,若质量增加,试样中肯定存在SO32-
B.试样溶液中加人稍过量的NH4C1溶液能得到与沉淀1成分相同的物质
C.上述流程步骤(1)(2) (3)的顺序改为(3)(2)(1),可能会获得相同的实验现象
D.试样溶液中肯定存在AlO2-、Cl-,其中Na+、K+至少存在1种
难度: 困难查看答案及解析