-
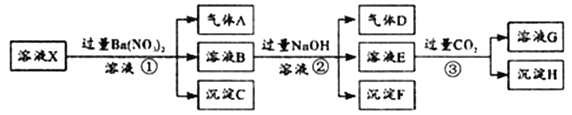
氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,工业大规模生产前,实验室先按如下流程进行模拟制备少量Mg(ClO3)2·6H2O:
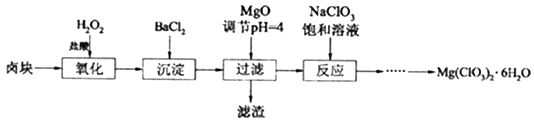
已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。②几种化合物的溶解度(S)随温度(T)变化曲线如右图。

(1)卤块中加H2O2的目的是________________,写出该反应的离子方程式__________________。
(2)加入BaCl2的目的是除去SO42-,如何检验SO42-已沉淀完全?_________________。
(3)常温下,加MgO调节pH=4后溶液中c(Fe3+)=___________(已知Ksp[Fe(OH)3=4×10-38],过滤所得滤渣的主要成分有______________。
(4)加入NaClO3饱和溶液公有NaCl晶体析出,写出该反应的化学方程式:___________,请利用该反应,结合上图,制取Mg(ClO3)2·6H2O的实验步骤依次为:
①取样,加入NaClO3饱和溶液充分反应;②蒸发结晶;③___________;④冷却结晶;⑤过滤、洗涤,获得Mg(ClO3)2·6H2O晶体。
-
Ⅰ.汽车尾气排放的NOX和CO污染环境,在汽车尾气系统中安装催化转化器,可有效降低NOX和CO的排放。
已知:①2CO(g)+O2(g) 2CO2(g), △H=-566.0kJ·mol-1
2CO2(g), △H=-566.0kJ·mol-1
②N2(g)+O2(g) 2NO(g) △H=+180.5 kJ·mol-1
2NO(g) △H=+180.5 kJ·mol-1
回答下列问题:
(1) CO的燃烧热为___________,若1molN2(g)、1molO2(g)分子中化学键断裂时分别需要吸收946kJ、498kJ的能量,则1molNO (g) 分子中化学键断裂时需吸收的能量为___________kJ。
(2)为了模拟反应2CO(g)+2NO(g) 2CO2(g)+N2(g) 在催化转化器内的工作情况,控制一定条件,让反应在恒容密闭容器中进行,用传感器测得不同时间NO和CO的浓度如表:
2CO2(g)+N2(g) 在催化转化器内的工作情况,控制一定条件,让反应在恒容密闭容器中进行,用传感器测得不同时间NO和CO的浓度如表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/(10-4 kJ·mol-1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO)/(10-3kJ·mol-1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
①前2s内的平均反应速率v(N2)___________。
②能说明上述反应达到平衡状态的是___________。
A.2n(CO2)=n(N2) B.混合气体的平均相对分子质量不变
C.气体密度不变 D.容器内气体压强不变
(3)在某恒容容器中发生下列反应:2NO2(g) 2NO(g)+O2(g),将一定量的NO2放入恒容密闭容器中,测得其平衡转化率随温度变化如图所示。
2NO(g)+O2(g),将一定量的NO2放入恒容密闭容器中,测得其平衡转化率随温度变化如图所示。
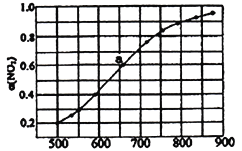
该反应为___________反应(填“吸热”或“放热”),已知图中a 点对应温度下,NO2的起始压强P0为120kPa,计算该温度 下反应的平衡常数 Kp 的值为___________。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
Ⅱ.N2H4-O2燃料电池是一种高效低污染的新型电池,其装置如图所示:
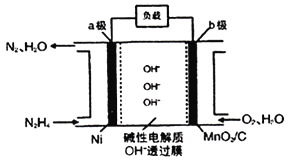
N2H4的电子式为___________ ;a极的电极反应方程式为___________;
-
氯及其化合物在工农业生产和日常生活中有着广泛的用途。
Ⅰ.实验室用下图所示装置制备KClO溶液,并通过KClO溶液与Fe(NO3)3溶液的反应制备高效水处理剂K2FeO4。已知K2FeO4具有下列性质①可溶于水、微溶于浓KOH溶液,②在0℃~5℃、强碱性溶液中比较稳定。
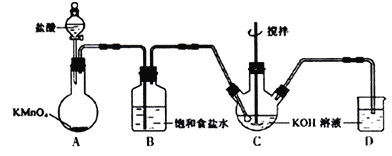
(1)装置A中的玻璃仪器的名称分别是___________。
(2)装置A中KMnO4与盐酸反应生成KCl、MnCl2和Cl2,其离子方程式为_______________________。将制备的Cl2通过装置B可除去___________ (填化学式)。
(3)Cl2和KOH在较高温度下反应生成KClO3。在不改变KOH溶液的浓度和体积的条件下,控制反应在0℃~5℃进行,实验中可采取的措施是___________________。
Ⅱ.某学习小组用下图装置制取并收集ClO2。(已知无水草酸在100℃可以升华)
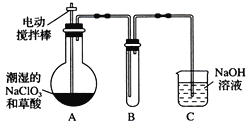
(1)实验时装置A需在60℃~100℃进行的原因是_________________________。
(2) 电动搅拌棒的作用是_______________________。
(3)装置A中反应产物有Na2CO3、ClO2和CO2等,用ClO2处理过的饮用水(pH为5.5~6.5)往往残留少量ClO2和一定量对人体不利的亚氯酸根高子(ClO2-)。
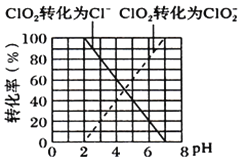
①ClO2被I-还原为ClO2-、Cl-的转化率与溶液pH的关系如图所示
②当pH≤2.0时,写出ClO2被I-还原的离子方程式________________________________。
③当pH 为7.0~8.0时,ClO2的还原产物为___________。
-
我国古代在西汉《淮南子·万毕术》一书中有湿法炼铜的文字记载: “曾青得铁则化铜”铜金属被广泛地应用于电力、电子、交通、轻工、新兴产业等领域。
回答下列问题:
(1) 铁原子的外围电子排布图为___________。
(2)向FeCl3溶液加入KSCN溶液形成K3[Fe(SCN)6]血红色溶液。
①写出与SCN-离子互为等电子体的合理分子或离子:_____________。(两个)
②铁原子的堆积方式如右图(甲)所示,其晶胞特征如右图(乙)所示,原子之间相互位置关系的平面图如右图(丙)所示; 已知铁原子半径rpm,铁晶胞空间利用率为:____________。(用字母π表示)

(3)含有Fe2+的水溶液可以用K3[Fe(CN)6]于实验室的定性检验,检验Fe2+离子的离子方程式为:___________。
(4)一水合硫酸四氨合铜[Cu(NH3)4]SO4·H2O 为蓝色正交晶体,常用作杀虫剂、媒染剂,在碱性镀铜中也常用作电镀液的主要成分,在工业上用途广泛。
①[Cu(NH3)4]SO4·H2O 中非金属元素H、N、O的电负性由大到小的顺序为:___________。(用元素符号作答)
②[Cu(NH3)4]SO4·H2O 晶体中存在的化学键有___________ (填编号)
a金属键 b离子键 c氢键 d 配位键 e极性键 f非极性键
③NH3分子的VSEPR模型为:___________;SO42-中S为___________杂化。
(5)铜的某种氧化物晶胞结构如图所示,若该晶胞的边长为acm,则该氧化物的密度为______g/cm3(设阿伏加德罗常数的值为NA)。

-
某高中化学兴趣小组设计合成高分子材料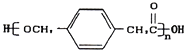
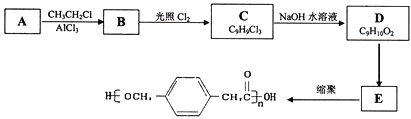
已知:
①A的相对分子质量为92;
②根据结构分析得知同一碳原子上连接两个羟基时结构不稳定,易脱水生成醛或酮;
③D可与新制的氢氧化铜反应;
回答下列问题:
(1)A的结构简式为:___________,B的名称为___________,由B生成C的反应类型是:___________。
(2) 由C生成D的化学方程式为:____________________________,反应过程中生成不稳定的中间产物结构简式为:___________。
(3)写出D转化为E的流程示意图:___________ (示例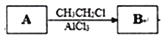 )
)
(4)E合成高分子材料的化学反应方程式:_________________________________。
(5)E的同分异构体中,满足下列条件的有___________种。
①仅含有苯环,无其他环状结构;
②苯环上只有两个取代基;
③能使三氯化铁溶液显紫色;
④ 含有 的结构;
的结构;
其中核磁共振氢谱表明分子中有六种氢,能发生银镜反应且其峰面积之比为2∶2∶2∶2∶1∶1
请写出其结构简式为:________________________。

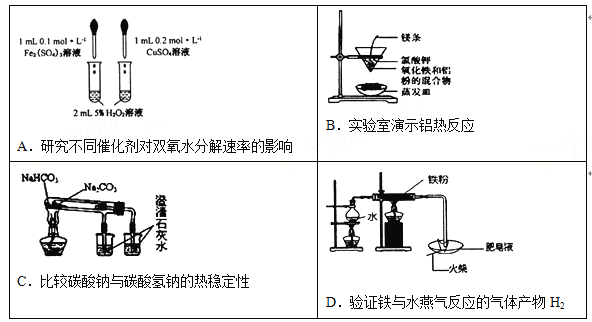
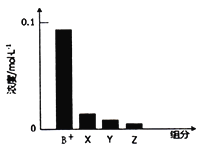
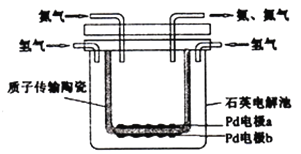











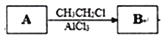 )
)