-
对中国古代著作涉及化学的叙述,下列解读错误的是
A. 《汉书》中“高奴县有洧水可燃”,这里的“洧水”指的是石油
B. 《天工开物》中“凡石灰、经火焚炼为用”里的“石灰”指的是Ca(OH)2
C. 《本草纲目》中“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”里的“碱”是K2CO3
D. 《黄白第十六》中“曾青涂铁,铁赤如铜”,其“曾青”是可溶性铜盐
难度: 中等查看答案及解析
-
下列有关物质的性质与用途具有对应关系的是
A. SiO2可溶于烧碱,烧碱可以用于玻璃雕花
B. CaO2能缓慢与水反应产生02,可用作水产养殖中的供氧剂
C. 铝具有良好导热性,可用铝罐贮运浓硝酸
D. FeCl3溶液具有酸性,可用作铜制线路板的蚀刻剂
难度: 中等查看答案及解析
-
下列说法正确的是
A. 节日燃放的烟花,是碱金属、锶、钡、铁等金属元素焰色反应呈现的
B. 向雨水中加入少量硫酸铁溶液会使浑浊的雨水变澄清
C. 液态水汽化时,氢键断开,干冰升华时,共价键断裂
D. 有六种分别含Na+、Mg2+、Al3+、Fe2+、Fe3+、NH4+阳离子的溶液,不能用NaOH溶液鉴别
难度: 中等查看答案及解析
-
下列化学用语的表示确的是
A. 原子结构示意图
只能表示12C原子
B. 黄钾铁矾[KFe3(SO4)2(OH)6]中,Fe的化合价为+2
C.
系统命名法为3-丁烯
D. 甲基的电子式为:
难度: 简单查看答案及解析
-
已知
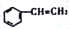 (x)、
(x)、 (y)
(y)  (z)互为同分异构体,下列说法不正确的是
(z)互为同分异构体,下列说法不正确的是A. z的二氯代物有三种
B. y的一氯代物有三种
C. x的加聚产物不能使溴的四氯化碳溶液褪色
D. x的所有原子可能处于同一平面
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列说法正确的是
A. 12.4gP4中所含共用电子对总数为0.4NA
B. 25℃时,pH=l的HC1溶液中含有H+的数目为0.1NA
C. 标准状况下,19gH218O2中所含电子总数为9NA
D. 1molSO2与0.5molO2在容积为V的容器中充分反应后转移电子数为2NA
难度: 中等查看答案及解析
-
下列有关“84”消毒液的叙述正确的是
A. 该溶液中,H+、NH4+、SO42-、I-可以大量共存
B. 该溶液中,Ag+、K+、NO3-、CH3CHO可以大量共存
C. 向该溶液中加入浓盐酸,可产生黄绿色气体
D. 该溶液中,CO32-、Al3+、Na+、AlO2-可以大量共存
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A. 稀硝酸与铁屑反应: 2Fe+6H+=2Fe3++3H2↑
B. 往NH4HCO3溶液中加过量的NaOH 溶液并加热: NH4++OH-=NH3↑+H2O
C. 往酸性碘化钾溶液中滴加适量的双氧水: 2I-+2H++H2O2=I2+2H2O
D. HS-的电离: HS-+ H2O
OH-+HS-
难度: 中等查看答案及解析
-
用下列实验方案及所选玻璃容器(非玻璃容器任选)就能实现相应实验目的是
实验目的
实验方案
玻璃仪器
A
除去KNO3中少量NaCl
将混合物制成热的饱和溶液,冷却结晶,过滤
酒精灯、烧杯、玻璃棒
B
证明CHCOOH的酸性强弱
用pH试纸测定浓度为0.1mol/LCH3COONa溶液的pH
玻璃棒、玻璃片
C
证明AgBr的溶度积比AgCl小
向AgNO3溶波中先滴加NaCl溶液,出现白色沉淀后,再向其中滴加同浓度的NaBr溶液
试管、滴管
D
配制1L16%的CuSO4溶液(溶液密度≈1g/mL)
将25gCuSO4·5H2O溶解在975g水中
烧杯、量筒、玻璃棒
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
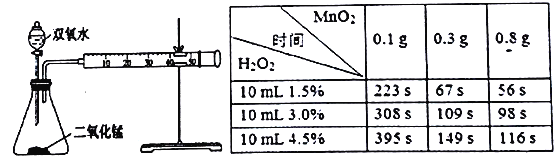
下列有关实验的说法正确的是
A. 向品红溶液中通入气体X,品红溶液褪色,则气体X可能是Cl2
B. CO2中含少量SO2,可将该混合气体通入足量饱和Na2CO3溶液中除去SO2
C. 向某溶液中滴加氯水,再滴加KSCN溶液,溶液变成红色,该溶液中一定含有Fe2+
D. 将SO2气体通入到Ba(N03)2溶液中生成白色沉淀,此沉淀是BaSO3
难度: 中等查看答案及解析
-
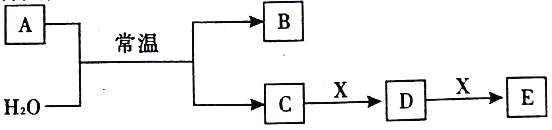
一定条件下A、B、C的如下图所示的转化关系,且△H=△H1+△H2。则A、C可能是( )
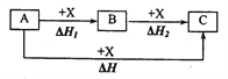
①Fe、FeCl3 ②C、CO2 ③AlCl3、NaAlO2 ④NaOH、NaHCO3 ⑤S、CuS ⑥Na2CO3、CO2
A.②③④⑥ B.②③④⑤⑥ C.①②③④⑥ D.①②③④⑤⑥
难度: 中等查看答案及解析
-
已知A(g)+B(g)
2C(g),反应过程混合物中C%与温度关系如下图,下列说法正确的是
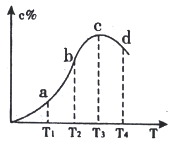
A. 正反应速率: v(c)>v(d)>v(b) B. 化学平衡常数: K(d)>K(c)
C. 由c向d变化时,v(正)<v(逆) D. 该可逆反应的正反应为吸热反应
难度: 中等查看答案及解析
-
近年科学家提出“绿色自由”构想。把含有CO2的空气吹入K2CO3溶被中,再把CO2从溶液中提取出来,并使之与H2反应生成可再生能源甲醇。其工艺流程如图所示,下列有关说法不正确的是
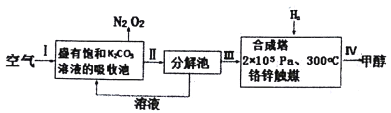
A. I、II两步目的是为了富集CO2
B. 从合成塔中及时分离出甲醇可以提高CO2的转化率
C. 过程中K2CO3可以循环使用
D. 铬锌触媒催化剂可以改变合成甲醇的焓变
难度: 中等查看答案及解析
-
中国科学家用毛笔书写后的纸张作为空气电极,设计并组装了轻型、柔性且可折叠的可充电锂空气电池(图1),电池的工作原理如图2。下列有关说法正确的是
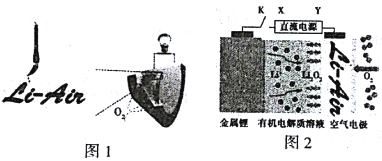
A. 放电时,纸张中的纤维素作锂电池的正极
B. 放电时,Li+由正极经过有机电解质溶液移向负极
C. 开关K闭合给锂电池充电,金属锂电极增重14g,空气电极放出22.4L的O2
D. 充电时,阳极的电极反应式为Li2O2-2e-=O2↑+2Li+
难度: 中等查看答案及解析
-
X、Y、Z、R、W是原子序数依次增大的5种短周期元素,它们可组成离子化合物Z2Y和共价化合物RY3、XW4,已知Y、R同主族,Z、R、W同周期。下列说法正确的是
A. 简单离子半径: R>Z>Y
B. Y元素简单氢化物的沸点高于R元素简单氢化物的沸点
C. W的氧化物对应水化物的酸性强于R的氧化物对应水化物的酸性
D. Y、Z、R三种元素组成的化合物的水溶液一定显碱性
难度: 中等查看答案及解析
-
25℃时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数[-lgc(M2+)]与溶液pH 的变化关系如图所示,已知该温度下Ksp[Cu(OH)2]< Ksp[Fe(OH)2]。下列说法正确的是
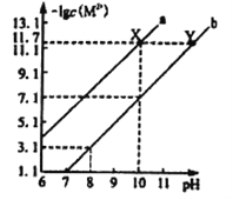
A. 曲线a表示Fe(OH)2饱和溶液中的变化关系
B. 除去CuSO4溶液中含有的少量Fe2+,可加入适CuO
C. 当Fe(OH)2和Cu(OH)2沉淀共存时,溶液中c(Fe2+):c(Cu2+)=104.6 :1
D. 向X点对应的饱和溶液中加入少量NaOH固体,可转化为Y 点对应的溶液
难度: 中等查看答案及解析