-
I.丙烯和乙烯都是石油化工最重要的基础原料。主要工业生产途径如下:
途径①CH3CH2CH3(g) CH2=CHCH3(g)+H2(g) △H1
CH2=CHCH3(g)+H2(g) △H1
途径②nCH3OH(g) CnH2n(g)+nH2O(g)(n为2或3) △H2<0
CnH2n(g)+nH2O(g)(n为2或3) △H2<0
回答下列问题:
(1)已知: 丙烷、丙烯、氢气的燃烧热分别为2219.9kJ/mol、2056.5 kJ/mol和285.8 kJ/mol,则△H1=_____ kJ/mol。
(2)途径①制备丙烯,要提高丙烯的产率最好采用______条件。(填“高压”或“低压”)
(3)途径②控制适当的条件(温度、压强、催化剂等)可以调节N[N=n(乙烯)/n(丙烯)] 在0~1.5之间变化,回答下列问题:
①要大幅度提高丙烯在最终产物中的比率,需要控制的适当条件是__________。
②在体积为V的反应器中加入一定量的甲醇,反应1h后,反应器中的压强增加了30%,则甲醇的转化率为______(用N=1进行计算)。
II: (4)含硫煤燃烧产生SO2,利用尿素[CO(NH2)2]水解的溶液可以吸收空气中的SO2。已知尿素水解放热,常温下水解反应较慢,水解的反应方程式如下: CO(NH2)2+H2O=H2NCOONH4(氨基甲酸铵)
①氨基甲酸铵会与空气中的SO2和O2反应生成(NH4)2SO4,该反应的化学方程式为________。
②-定条件下,用尿素水解液吸收空气中的SO2,测得SO2的吸收率随溶液的温度变化如图甲所示。温度高于60℃时,SO2的吸收率逐渐升高的原因是________。
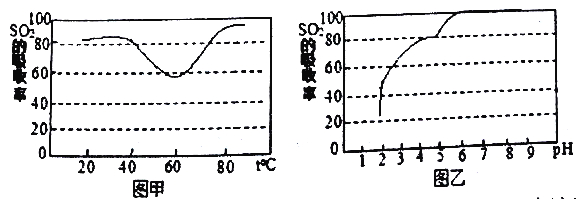
③尿素溶液吸收SO2的吸收率随溶液的pH变化如图乙所示。尿素深液吸收空气中的SO2后,溶液的pH会降低,为提高SO2的吸收率和充分回收产物,最好向溶液中加入______(填溶液的名称)并控制pH为_______。
-
1,2一二氯丙烷(CH2ClCHClCH3)是一种重要的化工原料,工业上可用丙烯加成法制备,主要副产物为3一氯丙烯(CH2=CHCH2Cl),反应原理为:
i .CH2 =CHCH3(g) +C12(g)⇌CH2ClCHClCH3(g) △H1=-134kJ•mol-1
ii . CH2 =CHCH3(g) +C12(g)⇌CH2= CHCH2Cl(g) +HCl(g) △H2 =-102kJ•mol-1
请回答下列问题:
(1)已知:CH2 =CHCH2Cl (g) + HCl ( g)⇌CH2ClCHClCH3(g)的正反应的活化能Ea(正)为132 kJ•mol-1,则逆反应的活化能Ea(逆)为__________ kJ•mol-1 。
(2)某研究小组向密闭容器中充入一定量的C12(g)和CH2 =CHCH3 ( g),分别在 A、B两种不同催化剂作用下发生反应,一段时间后测得CH2ClCHClCH3的产率与温度的关系如图1所示。

①下列说法正确的是______(填代号)。
a .使用催化剂A、B的最佳温度:A <B
b .p、m点分别是对应温度下CH2ClCHClCH3的平衡产率
c. 使用催化剂降低了反应的活化能和焓变
d. 温度不变,增大压强可使CH2ClCHClCH3的产率提高
②在250℃以后,A曲线中产率下降的原因可能是________(写出两条)。
(3)T℃时使用选择性更高的催化剂,在恒容密闭容器内充入等物质的量的C12 ( g) 和CH2=CHCH3 (g)进行反应i,测得容器各组分的分压强(p分=p总×体积分数)随时间的变化关系如图2所示,回答下列问题:
①若用单位时间内气体分压的变化来表示反应速率,即υ=  ,则t1~t2时间段内平均反应速率υ(CH2=CHCH3)= _______ kPa•min-1(用相关字母表示);平衡时CH2ClCHClCH3的体积分数________。
,则t1~t2时间段内平均反应速率υ(CH2=CHCH3)= _______ kPa•min-1(用相关字母表示);平衡时CH2ClCHClCH3的体积分数________。
②反应的平衡常数KP=_____________(用平衡分压代替平衡浓度,相关字母表示结果)。

(4)如图3是在酸性电解质溶液中,用惰性电极将CO2转化为低碳烯烃的电化学装置,回答下列问题:
①太阳能电池的负极是 __________(填“a”或“b”)。
②生成丙烯的电极反应式是____________。
③相同时间内,相同条件下,消耗的CO2与生成的O2 的体积之比为_________。
-
1,2-二氯丙烷(CH2ClCHClCH3)是一种重要的化工原料,工业上可用丙烯加成法制备,主要副产物为3-氯丙烯(CH2=CHCH2Cl),反应原理为:
I.CH2=CHCH3(g)+Cl2(g)  CH2ClCHClCH3(g) ∆H1=-134kJ·mol-1
CH2ClCHClCH3(g) ∆H1=-134kJ·mol-1
II.CH2=CHCH3(g)+Cl2(g) CH2=CHCH2Cl(g)+HCl(g) ∆H2=-102kJ·mol-1
请回答下列问题:
(1)已知CH2=CHCH2Cl(g)+HCl(g)  CH2ClCHClCH3(g)的活化能Ea(正)为132kJ·mol-1,则该反应的活化能Ea(逆)为___________kJ·mol-1。
CH2ClCHClCH3(g)的活化能Ea(正)为132kJ·mol-1,则该反应的活化能Ea(逆)为___________kJ·mol-1。
(2)一定温度下,密闭容器中发生反应I和反应II,达到平衡后增大压强,CH2ClCHClCH3的产率____________(填“增大”“减小”或“不变”),理由是_________________________________。
(3)起始时向某恒容绝热容器中充入1 mol CH2=CHCH3和1 mol Cl2发生反应II,达到平衡时,容器内气体压强_________________(填“增大”“减小”或“不变”)。
(4)某研究小组向密闭容器中充入一定量的CH2=CHCH3和Cl2,分别在A、B两种不同催化剂作用下发生反应,一段时间后测得CH2ClCHClCH3的产率与温度的关系如图所示。p点是否为对应温度下CH2ClCHClCH3的平衡产率,_________填“是”或“否”)判断理由是_______________________。

(5)一定温度下,向恒容密闭容器中充入等物质的量的CH2=CHCH3(g)和Cl2(g)。在催化剂作用下发生反应I,容器内气体的压强随时间的变化如下表所示。
| 时间/min | 0 | 60 | 120 | 180 | 240 | 300 | 360 |
| 压强/kPa | 80 | 74.2 | 69.4 | 65.2 | 61.6 | 57.6 | 57.6 |
①用单位时间内气体分压的变化来表示反应速率,即 ,则前120min内平均反应速率v(CH2ClCHClCH3)=__________ kPa·min-1。(保留小数点后2位)。
,则前120min内平均反应速率v(CH2ClCHClCH3)=__________ kPa·min-1。(保留小数点后2位)。
②该温度下,若平衡时HCl的体积分数为 ,则丙烯的平衡总转化率
,则丙烯的平衡总转化率 ____________;反应I的平衡常数Kp=____________________kPa-1(Kp为以分压表示的平衡常数,保留小数点后2位)。
____________;反应I的平衡常数Kp=____________________kPa-1(Kp为以分压表示的平衡常数,保留小数点后2位)。
-
1,2-二氯丙烷(CH2C1CHClCH3)是一种重要的化工原料,工业上可用丙烯加成法制备,主要副产物为3-氯丙烯(CH2=CHCH2C1),反应原理为:
I.CH2=CHCH3(g)+C12(g) CH2C1CHC1CH3(g) △H1=—134kJ·mol-1
CH2C1CHC1CH3(g) △H1=—134kJ·mol-1
II.CH2=CHCH3(g)+C12(g) CH2=CHCH2C1(g)+HC1(g)△H2=—102kJ·mol-1
CH2=CHCH2C1(g)+HC1(g)△H2=—102kJ·mol-1
请回答下列问题:
(1)已知CH2=CHCH2C1(g)+HC1(g) CH2C1CHC1CH3(g)的活化能Ea(正)为132kJ·mol-1,则该反应的活化能Ea(逆)为______kJ·mol-1。
CH2C1CHC1CH3(g)的活化能Ea(正)为132kJ·mol-1,则该反应的活化能Ea(逆)为______kJ·mol-1。
(2)一定温度下,向恒容密闭容器中充入等物质的量的CH2=CHCH3(g)和C12(g)。在催化剂作用下发生反应I、Ⅱ,容器内气体的压强随时间的变化如下表所示。
| 时间/min | 0 | 60 | 120 | 180 | 240 | 300 | 360 |
| 压强/kPa | 80 | 74.2 | 69.4 | 65.2 | 61.6 | 57.6 | 57.6 |
①用单位时间内气体分压的变化来表示反应速率,即 ,则前120min内平均反应速率v(CH2C1CHC1CH3)=______kPa·min-1。(保留小数点后2位)。
,则前120min内平均反应速率v(CH2C1CHC1CH3)=______kPa·min-1。(保留小数点后2位)。
②该温度下,若平衡时HC1的体积分数为 ,则丙烯的平衡总转化率
,则丙烯的平衡总转化率 _______;反应I的平衡常数Kp=_____kPa-1(Kp为以分压表示的平衡常数,保留小数点后2位)。
_______;反应I的平衡常数Kp=_____kPa-1(Kp为以分压表示的平衡常数,保留小数点后2位)。
(3)某研究小组向密闭容器中充入一定量的CH2=CHCH3和C12,分别在A、B两种不同催化剂作用下发生反应,一段时间后测得CH2C1CHC1CH3的产率与温度的关系如下图所示。

①下列说法错误的是___________(填代号)。
a.使用催化剂A的最佳温度约为250℃
b.相同条件下,改变压强不影响CH2C1CHC1CH3的产率
c.两种催化剂均能降低反应的活化能,但△H不变
d.提高CH2C1CHC1CH3反应选择性的关键因素是控制温度
②在催化剂A作用下,温度低于200℃时,CH2C1CHC1CH3的产率随温度升高变化不大,主要原因是_______________________________________________________________。
③p点是否为对应温度下CH2C1CHC1CH3的平衡产率,判断理由是_____________。
-
1,2-二氯丙烷(CH2ClCHClCH3)是重要的化工原料,工业上可用丙烯加成法生产,主要副产物为3-氯丙烯(CH2=CHCH2C1) ,反应原理为
i. CH2=CHCH,3(g)+Cl2(g) CH2ClCHClCH3(g) ΔH1= -134 kJ• mol-1
CH2ClCHClCH3(g) ΔH1= -134 kJ• mol-1
ii. CH2=CHCH,3(g)+Cl2(g) CH2=CHCH2Cl (g)+HCl(g) ΔH2= -l02 kJ • mol-1
CH2=CHCH2Cl (g)+HCl(g) ΔH2= -l02 kJ • mol-1
已知:相关化学键的键能数据如下表所示:
| 化学键 | C—C | C—C | C—Cl | Cl—Cl |
| E/( kJ • mol-1) | 611 | x | 328 | 243 |
请回答下列问题:
(1)由反应i计算出表中x=_____________。
(2)一定温度下,密闭容器中发生反应i和反应ii,达到平衡后增大压强,CH2C1CHC1CH3的产率____________(填“增大”“减小”或“不变”),理由是_________________________________。
(3)T1℃时,向10L恒容的密闭容器中充入1 mol CH2=CHCH2C1和2 mol HC1,只发生反应CH2=CH CH2Cl (g)+HCl(g) CH2ClCHClCH3(g) ΔH3。5min反应达到平衡,测得 0〜5 min内,用CH2ClCHClCH3表示的反应速率 v(CH2ClCHClCH3)=0.016 mol·L-1 • min-1。
CH2ClCHClCH3(g) ΔH3。5min反应达到平衡,测得 0〜5 min内,用CH2ClCHClCH3表示的反应速率 v(CH2ClCHClCH3)=0.016 mol·L-1 • min-1。
①平衡时,HCl的体积分数为__________________(保留三位有效数字)。
②保持其它条件不变,6 min时再向该容器中充入0. 6 mol CH2=CHCH2Cl、0.2molHC1和0.1mol CH2ClCHClCH3,则起始反应速率 v正(HCl)______________ (填“>”“<”或“=”)V逆(HCl).
(4)一定压强下,向密闭容器中充入一定量的CH2=CHCH3和C12发生反应ii。设起始的 =w,平衡时Cl2的体积分数(φ)与温度(T)、w的关系如图甲所示。W=1时,正、逆反应的平衡常数(K)与温度(T)的关系如图乙所示。
=w,平衡时Cl2的体积分数(φ)与温度(T)、w的关系如图甲所示。W=1时,正、逆反应的平衡常数(K)与温度(T)的关系如图乙所示。

①图甲中,w2__________(填“>”“<”或“=”)1
②图乙中,表示正反应平衡常数的曲线为____________(填“A”或“B”),理由为________________。
③T1K下,平衡时a(Cl2)= ________________。
(5)起始时向某恒容绝热容器中充入1 mol CH2 =CHCH3和1 mol Cl2发生反应ii,达到平衡时,容器内气体压强_________________(填“增大”“减小”或“不变”)。
-
下列说法不正确的是( )
A.淀粉、油脂、亚油酸的组成元素中均只含C、H、O
B.工业生产石油化工中的重要基础原料乙烯,主要原理是发生消去反应
C.3M防颗粒物口罩含有聚丙烯,聚丙烯属于高分子,不能使酸性高锰酸钾溶液褪色
D.将植物的秸杆、枝叶、杂草和人畜粪便加入沼气发酵池中,一定条件下生成沼气,属于生物质能的生物化学转换
-
丙烯腈(CH2===CHCN)是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产,主要副产物有丙烯醛(CH2===CHCHO)和乙腈(CH3CN)等。回答下列问题:
(1)以丙烯、氨、氧气为原料,在催化剂存在下生成丙烯腈(C3H3N)和副产物丙烯醛(C3H4O)的热化学方程式如下:
①C3H6(g)+NH3(g)+ O2(g)===C3H3N(g)+3H2O(g) ΔH=-515 kJ·mol-1
O2(g)===C3H3N(g)+3H2O(g) ΔH=-515 kJ·mol-1
②C3H6(g)+O2(g)===C3H4O(g)+H2O(g) ΔH=-353 kJ·mol-1
两个反应在热力学上趋势均很大,其原因是_________________________________________________________________;
有利于提高丙烯腈平衡产率的反应条件是_________________________________________________________________;
提高丙烯腈反应选择性的关键因素是________________________________________________________________。
(2)图(a)为丙烯腈产率与反应温度的关系曲线,最高产率对应的温度为460 ℃,低于460 ℃时,丙烯腈的产率________(填“是”或“不是”)对应温度下的平衡产率,判断理由是___________________________________________;
高于460 ℃时,丙烯腈产率降低的可能原因是________(双选,填标号)。
A.催化剂活性降低 B.平衡常数变大
C.副反应增多 D.反应活化能增大

(3)丙烯腈和丙烯醛的产率与n(氨)/n(丙烯)的关系如图(b)所示。由图可知,最佳n(氨)/n(丙烯)约为________,理由是___________________________________,进料气氨、空气、丙烯的理论体积比约为________。
-
丙烯腈(CH2=CHCN)是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产,主要副产物有丙烯醛(CH2=CHCHO)和乙腈 CH3CN 等,回答下列问题:
(1)以丙烯、氨、氧气为原料,在催化剂存在下生成丙烯腈( C3H3N)和副产物丙烯醛( C3H4O)的热化学方程式如下:
①C3H6(g)+NH3(g)+1.5O2(g)=C3H3N(g)+3H2O(g) △H=-515kJ·mol-1
②C3H6(g)+O2(g)=C3H4O(g)+H2O(g) △H=-353kJ·mol-1
两个反应在热力学上趋势均很大,其原因是____________;有利于提高丙烯腈平衡产率的反应条件是_______________;提高丙烯腈反应选择性的关键因素是___________。
(2)图(a)为丙烯腈产率与反应温度的关系曲线,最高产率对应温度为460℃。低于460℃时,丙烯腈的产率___________(填“是”或者“不是”)对应温度下的平衡产率,判断理由是______________;高于460℃时,丙烯腈产率降低的可能原因是___________(双选,填标号)。
A.催化剂活性降低 B.平衡常数变大 C.副反应增多 D.反应活化能增大
(3)丙烯腈和丙烯醛的产率与 n(氨) /n(丙烯)的关系如图(b所示。

由图可知,最佳 n(氨) /n(丙烯)约为_____________,理由是______________________。进料氨、空气、丙烯的理论体积约为____________。
-
丙烯腈(CH2=CHCN)是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产,主要副产物有丙烯醛(CH2=CHCHO)和乙腈(CH3CN)等,回答下列问题:
(1)以丙烯、氨、氧气为原料,在催化剂存在下生成丙烯腈(C3H3N)和副产物丙烯醛(C3H4O)的热化学方程式如下:
①C3H6(g)+NH3(g)+ 3/2O2(g)=C3H3N(g)+3H2O(g) ΔH=-515kJ/mol
①C3H6(g)+ O2(g)=C3H4O(g)+H2O(g) ΔH=-353kJ/mol
两个反应在热力学上趋势均很大,其原因是________;有利于提高丙烯腈平衡产率的反应条件是________;提高丙烯腈反应选择性的关键因素是________。
(2)图(a)为丙烯腈产率与反应温度的关系曲线,最高产率对应温度为460℃。低于460℃时,丙烯腈的产率________(填“是”或者“不是”)对应温度下的平衡产率,判断理由是________;高于460℃时,丙烯腈产率降低的可能原因是________(双选,填标号)
A.催化剂活性降低 B.平衡常数变大C.副反应增多 D.反应活化能增大

(3)丙烯腈和丙烯醛的产率与n(氨)/n(丙烯)的关系如图(b)所示。由图可知,最佳n(氨)/n(丙烯)约为,理由是_______________。进料氨、空气、丙烯的理论体积约为________。
-
丙烯腈(CH2=CHCN)是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产,主要副产物有丙烯醛(CH2=CHCHO)和乙腈CH3CN等,回答下列问题:
(1)以丙烯、氨、氧气为原料,在催化剂存在下生成丙烯腈(C3H3N)和副产物丙烯醛(C3H4O)的热化学方程式如下:
①C3H6(g)+NH3(g)+ 3/2O2(g)=C3H3N(g)+3H2O(g) △H=-515kJ/mol
①C3H6(g)+ O2(g)=C3H4O(g)+H2O(g) △H=-353kJ/mol
两个反应在热力学上趋势均很大,其原因是;有利于提高丙烯腈平衡产率的反应条件是;提高丙烯腈反应选择性的关键因素是。
(2)图(a)为丙烯腈产率与反应温度的关系曲线,最高产率对应温度为460OC.低于460OC时,丙烯腈的产率(填“是”或者“不是”)对应温度下的平衡产率,判断理由是;高于460OC时,丙烯腈产率降低的可能原因是 (双选,填标号)
A.催化剂活性降低
B.平衡常数变大
C.副反应增多
D.反应活化能增大
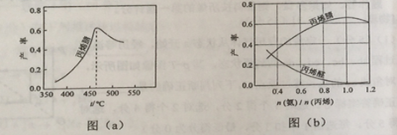
(3)丙烯腈和丙烯醛的产率与n(氨)/n(丙烯)的关系如图(b)所示。由图可知,最佳n(氨)/n(丙烯)约为 ,理由是 。进料氨、空气、丙烯的理论体积约为 。
CH2=CHCH3(g)+H2(g) △H1
CnH2n(g)+nH2O(g)(n为2或3) △H2<0









