-
蛋壳的主要成分是CaCO3,含有少量的SiO2、MgCO3及色素等杂质,测定蛋壳中钙含量的操作步骤如图所示:
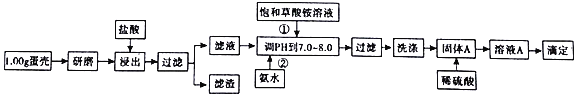
已知: CaC2O4、MgC2O4都难溶于水。
回答下列问题:
(1)样品溶于盐酸后得到的滤渣主要是______________。
(2)①②操作时,加入饱和(NH4)2C2O4溶液和氨水的作用是_________。
(3)洗涤固体A最好选用“冰水”洗涤,其目的是___________。
(4)在一定温度下,向2L的密闭容器中放人足量的草酸钙(固体所占体积忽略不计)发生反应: CaC2O4(s) CaO(s)+CO(g)+CO2(g) 若前5min内生成CaO的质量为l1.2g,则该段时间内v(CO)=_________。
CaO(s)+CO(g)+CO2(g) 若前5min内生成CaO的质量为l1.2g,则该段时间内v(CO)=_________。
(5)用标准酸性高锰酸钾溶液滴定生成的草酸,通过钙与草酸的定量关系,可间接求出钙的含量。
步骤1: 将溶液A加蒸馏水稀释至250mL。
步骤2: 取稀释后的溶液25.00mL于锥形瓶中,加稀H2SO4酸化。
步骤3: 用0.0190mol/LKMnO4溶液滴定步骤2所得溶液至终点,消耗KMnO4溶液V1mI。
步骤4: 重复步骤2、步骤3的操作3次,记录数据如下表:
| 实验编号 | KMnO4溶液的浓度(mol/L) | KMnO4液滴入的体积(mL) |
| 1 | 0.0190 | V1=20.02 |
| 2 | 0.0190 | V2=20.00 |
| 3 | 0.0190 | V3=19.98 |
| 4 | 0.0190 | V4=20.80 |
①滴定终点的现象是______________________。
②该蛋壳中CaCO3的质量分数=______%,则此法求得的钙含量_____实际值(填“>”“=”或“<”)。
-
CMA(醋酸钙、醋酸镁固体的混合物)是高速公路的绿色融雪剂。以生物质废液——木醋液(主要成分乙酸,以及少量的甲醇、苯酚、焦油等杂质)及白云石(主要成分MgCO3·CaCO3,含SiO2等杂质)等为原料生产CMA的实验流程如图:
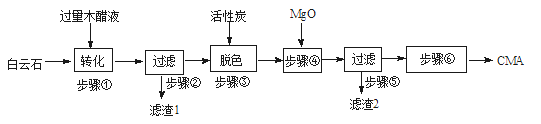
(1)步骤①发生的反应离子方程式为___________________。
(2)步骤②所得滤渣1的主要成分为____________(写化学式);步骤②所得滤液常呈褐色,颜色除与木醋液中含有少量的有色的焦油有关外,产生颜色的另一主要原因是____________。
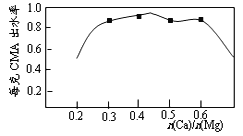
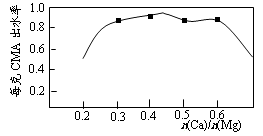
(3)已知CMA中钙、镁的物质的量之比与出水率(与融雪效果成正比)关系如图所示,步骤④的目的除调节n(Ca)∶n(Mg)约为____________(选填:1∶2;3∶7;2∶3)外,另一目的是___________________。
(4)步骤⑥包含的操作有____________、过滤、洗涤及干燥。
(5)碳酸镁和碳酸钙与醋酸也可以恰好完全反应得到的混合物制融雪剂,下列有关说法错误的是_____
A.该融雪剂中的醋酸钙、醋酸镁均是离子化合物
B.该融雪剂还可用于除去煤燃烧产生的二氧化硫
C.该融雪剂的水溶液显碱性
D.生产该融雪剂所需碳酸盐与醋酸的物质的量之比为1:1
-
CMA(醋酸钙、醋酸镁固体的混合物)是高速公路的绿色融雪剂。以生物质废液——木醋液(主要成分乙酸,以及少量的甲醇、苯酚、焦油等杂质)及白云石(主要成分MgCO3·CaCO3,含SiO2等杂质)等为原料生产CMA的实验流程如下:

(1)步骤①发生的反应离子方程式为 。
(2)步骤②所得滤渣1的主要成分为 (写化学式);步骤②所得滤液常呈褐色,颜色除与木醋液中含有少量的有色的焦油有关外,产生颜色的另一主要原因是 。
(3)已知CMA中钙、镁的物质的量之比与出水率(与融雪效果成正比)关系如右图所示,步骤④的目的除调节n(Ca)∶n(Mg)约为 (选填: 1∶2;3∶7;2∶3)外,另一目的是 。
(4)步骤⑥包含的操作有 、过滤、洗涤及干燥。
-
CMA(醋酸钙、醋酸镁固体的混合物)是高速公路的绿色融雪剂。以生物质废液——木醋液(主要成分乙酸,以及少量的甲醇、苯酚、焦油等杂质)及白云石(主要成分MgCO3·CaCO3,含SiO2等杂质)等为原料生产CMA的实验流程如下:

(1)步骤①发生的反应离子方程式为 。

(2)步骤②所得滤渣1的主要成分为 (写化学式);步骤②所得滤液常呈褐色,颜色除与木醋液中含有少量的有色的焦油有关外,产生颜色的另一主要原因是 。
(3)已知CMA中钙、镁的物质的量之比与出水率(与融雪效果成正比)关系如图所示,步骤④的目的除调节n(Ca)∶n(Mg)约为 (选填:1∶2;3∶7;2∶3)外,另一目的是 。
(4)步骤⑥包含的操作有 、过滤、洗涤及干燥。
-
某地菱锰矿的主要成分为MnCO3,还含有少量的FeCO3、CaCO3、MgCO3、Al2O3等杂质,工业上以菱锰矿为原料制备高纯度碳酸锰的流程如图所示:
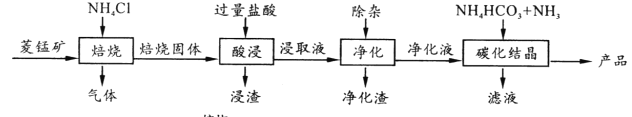
已知:MnCO3+2NH4Cl  MnCl2 +CO2 ↑+2NH3 ↑+H2O↑
MnCl2 +CO2 ↑+2NH3 ↑+H2O↑
(1)焙烧时温度对锰浸取率的影响如图。
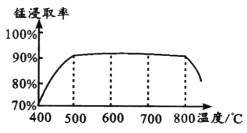
焙烧时适宜温度为_____ ;800℃以上锰的浸取率偏低,可能原因是________。
(2)净化包含三步: ①加入少量MnO2,反应的离子方程式为___;
②加氨水调pH,生成沉淀主要是_________;
③加入NH4F,除去Ca2+、Mg2+。
(3)碳化结晶中生成MnCO3的离子方程式为___________。
(4)滴定法测产品纯度
I 取固体产品1.160 g 于烧杯中,加入过量稀H2SO4充分振荡,再加入NaOH 溶液至碱性,发生反应2Mn2+ +O2 +4OH-=2MnO(OH)2;
II 加入过量KI 溶液和适量稀H2SO4,发生反应:MnO(OH)2 +2I-+4H+=Mn2+ + I2 +3H2O;
III 取I中混合液的1/10于锥形瓶中,加入淀粉溶液作指示剂,用0.1000 mol/LNa2S2O3溶液进行滴定,发生反应:2S2O32-+I2=S4O62-+2I-,滴定终点时消耗Na2S2O3溶液20.00 mL。
①判断滴定终点的方法是____________。
②假设杂质不参与反应,则产品纯度为________。
-
长余辉材料在发光照明、交通等领域具有广泛的应用前景。下图是一种利用大理石(主要成分CaCO3和MgCO3)和铝土矿(主要成分Al2O3,还含少量Fe2O3杂质)制备一种长余辉材料(Ca12Al14Ox)的工艺流程图。回答下列问题:
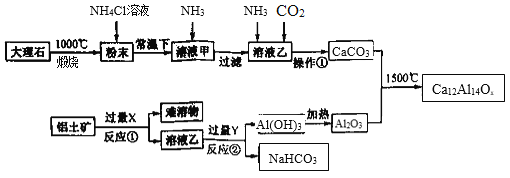
(1)Ca12Al14Ox中x的数值为 ______,试剂X的名称是_________。
(2)NH4Cl溶液能溶解“粉末”的原因是_________,发生的主要反应的化学方程为______。
(3)反应②的离子方程式为 _______。
(4)实验室加热Al(OH)3应在________(填仪器名称)进行;操作①包括_____、干燥等。
(5)若溶液甲中c(Mg2+) <5×10-5mol•L-1元素损失,此时应调节溶液pH大于______,为减少钙元素损失,应控制溶液甲中c(Ca2+)≤______。常温下Ksp[Mg(OH)2]=5×10-11,Ksp[Ca(OH)2]=5×10-6。
-
麦秸杆、木屑等废料经干馏制燃料气过程中产生大量的废液,俗称木醋液(主要成分乙酸,还含少量的甲醇、苯酚、焦油等)。以木醋液与白云石(主要成分2MgCO3·3CaCO3,还含有SiO2等杂质)等为原料,可制备出绿色环保型融雪剂CMA(醋酸钙、醋酸镁固体的混合物)。
CMA生产流程如下:
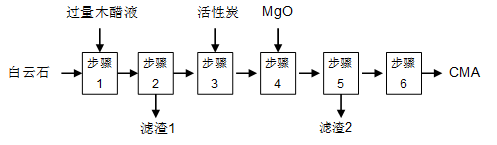
(1)步骤①发生反应的离子方程式为 ________________。
(2)滤渣1的主要成分为 (写化学式);步骤②所得滤液常呈褐色,颜色除与木醋液中含有少量的有色焦油外,产生颜色的另一主要原因是 。
(3)步骤③是往滤液中加活性炭粉,可使滤液脱色,这是利用了活性炭具有 。
实验测知CMA中钙、镁离子的物质的量之比与出水率(与融雪效果成正比)的关系如图。
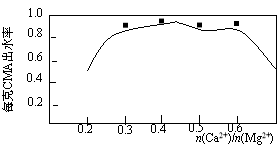
(4)由图知,当CMA中n(Ca2+)∶n(Mg2+)约为 时融雪的效果最好。(选填字母)
a.1∶2 b.3∶7 c.2∶3
步骤④的目的主要是 , 。
(5)步骤⑥包含的操作有 、过滤、洗涤及干燥。
-
二氧化锆(ZrO2)是最重要的氧离子固体电解质,用于制造燃料电池、氧气含量测定仪等。可由锆英砂(主要成分为ZrSiO4,也可表示为ZrO2·SiO2;含有少量Fe2O3、Al2O3、SiO2杂质)通过如下工艺流程法制得。
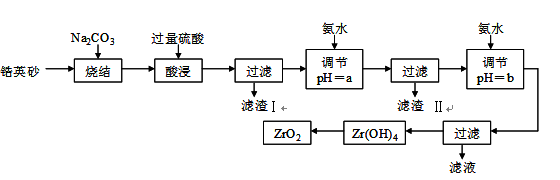
已知:①ZrO2具有两性,高温与纯碱共熔生成可溶于水的Na2ZrO3,与酸反应生成ZrO2+。②部分金属离子开始沉淀和完全沉淀的pH如下表:
| 金属离子 | Fe3+ | Al3+ | ZrO2+ |
| 开始沉淀的pH | 1.9 | 3.3 | 6.2 |
| 沉淀完全的pH | 3.2 | 5.2 | 8.0 |
请回答下列问题:
⑴烧结时ZrSiO4发生反应的化学方程式为_______________________;
滤渣I的化学式为______________________________。
⑵调节pH=a 的目的是________________________________________;用氨水调节pH=b后发生反应的离子方程式为______________________________________________。
⑶以滤渣II为主要原料制取铁红,请简述实验方法________________________。
⑷工业上用铝热法冶炼锆,写出以ZrO2通过铝热法制取锆的化学方程式:
________________________________________________________。
⑸一种新型燃料电池用掺杂Y2O3的ZrO2晶体作电解质在熔融状态下传导O2-,一极通入空气,另一极通入甲烷,写出负极的电极反应式为___________________________。
-
二氧化锆(ZrO2)是最重要的氧离子固体电解质,用于制造燃料电池、氧气含量测定仪等。可由锆英砂(主要成分为ZrSiO4,也可表示为ZrO2·SiO2;含有少量Fe2O3、Al2O3、SiO2杂质)通过如工艺流程法制得。
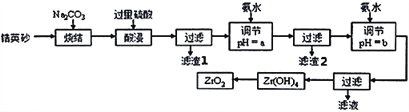
已知:①ZrO2具有两性,高温与纯碱共熔生成可溶于水的Na2ZrO3,与酸反应生成ZrO2+。
②部分金属离子在实验条件下开始沉淀和完全沉淀的pH如下表。
| 金属离子 | Fe3+ | Al3+ | ZrO2+ |
| 开始沉淀时pH | 1.9 | 3.3 | 6.2 |
| 沉淀完全时pH | 3.2 | 5.2 | 8.0 |
请回答下列问题:
(1)已知Zr元素的原子序数是40,请写出它在周期表中的位置:____________________________。
(2)烧结时ZrSiO4发生反应的化学方程式为__________________________;滤渣1的化学式为__________。
(3)调节pH=a时,a的范围应该是__________________;用氨水调节pH=b时,所发生反应的离子方程式为_______________________________________。
(4)本题的流程中,一共有三步过滤操作,北中最后一步过滤所得的Zr(OH)4沉淀需要洗涤,证明该沉淀已经洗涤干净的最佳操作方法是:______________________________________。
(5)工业上用铝热法冶炼锆,写出以ZrO2通过铝热法制取锆的化学方程式:________________。
(6)一种新型燃料电池用掺杂Y2O3的ZrO2晶体作电解质在熔融状态下传导O2-,一极通入空气,另一极通入乙烷,写出负极的电极反应式:________________________________。
-
白云石的主要成分为CaCO3、MgCO3,还含有少量Fe、Si的化合物,实验室以白云石为原料制Mg(OH)2及CaCO3。步骤如下:

实验过程中需要的数据见下表:
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH |
| Fe3+ | 1.9 | 3.2 |
| Fe2+ | 7.0 | 9.0 |
| Mg2+ | 9.5 | 11.0 |
请回答下列问题:
(1)过滤中所需的玻璃仪器是________。溶液A中含有Ca2+,Mg2+,Fe2+,Fe3+,则试剂①可选择
________(填字母)
A.KMnO4 B.Cl2 C.H2O2
(2)若要利用反应过程中生成的CO2,从溶液D中制取CaCO3,需要先通入的一种气体是________,然后通入CO2。通入CO2气体时请把右边的装置图补充完整(不允许更换溶液,导气管以下连接的仪器自选)。
(3)根据表中提供的数据判断,Fe(OH)3、Fe(OH)2和Mg(OH)2的溶度积常数由小到大的排列顺序为________。
(4)若将制取的Mg(OH)2:加入到某聚乙烯树脂中,树脂可燃性大大降低,Mg(OH)起阻燃作用的主要原因是________。

CaO(s)+CO(g)+CO2(g) 若前5min内生成CaO的质量为l1.2g,则该段时间内v(CO)=_________。














