-
下列有关化学用语的表示正确的是
A.甲烷分子的球棍模型:
B.HClO的结构式:H-Cl-O
C.质子数为53,中子数为78的碘原子:
D.熔融状态下硫酸氢钾的电离方程式:KHSO4
K++H++SO42-
难度: 中等查看答案及解析
-
已知:2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1
H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1
下列说法正确的是
A.H2(g)的燃烧热为571.6 kJ·mol-1
B.
H2SO4(aq)+
Ba(OH)2(aq)===
BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
C.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
D.3H2(g)+CO2(g)===CH3OH(l)+H2O(l) ΔH=+131.4 kJ·mol-1
难度: 简单查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大,原子半径:r(W)>r(Y)>r(Z)>r(X)。X与W同主族,Z原子最外层电子数是其内层电子总数的3倍,Z原子的核电荷数等于X、Y原子核电荷数之和。下列说法正确的是
A.元素Z、W的简单离子的电子层结构不同
B.元素Y的简单气态氢化物的热稳定性比Z的强
C.由X、Y、Z三种元素形成的化合物的水溶液可能呈碱性
D.化合物X2Z2与W2Z2所含化学键类型完全相同
难度: 简单查看答案及解析
-
最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:
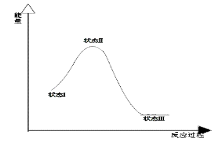
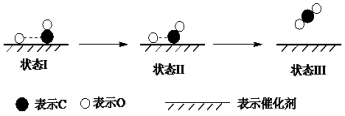
下列说法正确的是
A.CO和O生成CO2是吸热反应
B.在该过程中,CO断键形成C和O
C.CO和O生成了具有极性共价键的CO2
D.状态Ⅰ→状态Ⅲ表示CO与O2反应的过程
难度: 中等查看答案及解析
-
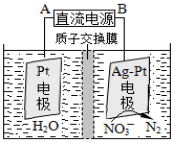
科技工作者研究出以NH3 为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池(如图所示)。该固体氧化物电解质的工作温度高达700~900 ℃,O2-可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质。下列说法正确的是
A.电极甲为电池正极
B.电池总反应为4NH3+5O2 =4NO+6H2O
C.电池正极反应式为O2+2H2O+4e-=4OH-
D.图示中的O2-由电极乙移向电极甲
难度: 简单查看答案及解析
-
某氖原子的质量是a g,12C原子的质量是bg用NA表示阿伏加德罗常数,则以下叙述中错误的是
A.该氖原子的相对原子质量为12a/b
B.Wg该氖原子的物质的量为W/aNA mol
C.Wg 该氖原子所含的质子数为 10W/a个
D.氖元素的摩尔质量为aNA g/mol
难度: 简单查看答案及解析
-
已知W、X、Y、Z为短周期元素,它们的原子半径依次增大,W与Z、X和Y分别同主族,Y、 Z同周期。Z能与X形成两种常见的离子化合物,离子个数比均为2:1。下列说法错误的是
A.Y、Z、X、W的原子序数依次减小
B.W与X可形成既含极性共价键又含非极性共价键的化合物
C.由W、X、Y、Z四种元素组成的常见化合物一定显酸性
D.X的简单氢化物的沸点低于Y的简单氢化物的沸点
难度: 简单查看答案及解析
-
空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。RFC的工作原理如图所示。下列有关说法正确的是
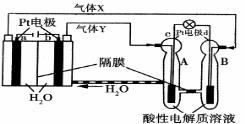
A.当有0.1 mol电子转移时,a电极产生2.24 L H2
B.b电极上发生的电极反应式为4H2O+4e-===2H2↑+4OH-
C.c电极上进行还原反应,B池中的H+可以通过隔膜进入A池
D.d电极上发生的电极反应式为O2+4H++4e-===2H2O
难度: 中等查看答案及解析
-
下列叙述错误的是:
①热稳定性:H2O>HF>H2S
②熔点:Al>Na>K
③ⅡA族元素的阳离子与上周期稀有气体元素的原子具有相同的核外电子排布
④元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
⑤多电子原子中,在离核较近的区域内运动的电子能量较高
⑥已知H2SO4(aq)+2NaOH(aq)=2H2O(l)+Na2SO4(aq) △H= -114.6kJ·mol-1则中和热为57.3kJ·mol-1
⑦两个非金属元素原子间只可能形成共价键,而含金属元素的化合物中一定含离子键
A.②④⑥ B.①⑤⑥ C.②③④ D.①⑤⑦
难度: 困难查看答案及解析
-
科学家研制出了一种新型的贮氢材料—。这种镁铝合金的成分可表示为Mg17Al12。其贮氢和释氢的原理可表示为:Mg17Al12+17H2
17MgH2+12Al下列有关说法正确的是
A.Mg17Al12是离子化合物
B.为防止金属氧化,熔炼制备Mg17Al12时通氮气做保护气
C.732 g的合金能吸收380.8 L氢气
D.该合金的熔点比镁和铝的熔点低
难度: 中等查看答案及解析
-
元素X~Z是元素周期表中4种主族元素,其性质或结构信息如下表,有关下列元素的描述错误的是
元素
X
Y
W
Z
相关信息
用硫酸处理海藻灰时,可得通常状况下为紫黑色的固体,其制剂可用来消毒
工业上在冰晶石存在的条件下,用电解法制取其单质
最早是在用氯气处理提取食盐后的盐水母液中发现的,被称作“海洋元素”
原子的电子总数是最外层电子数的6倍
A.实验室可在海藻灰的浸出液中滴加双氧水来制取元素X的单质
B.元素X、Y的单质充分混合后滴加少量水,可看到大量紫色蒸汽生成,说明该反应会放出大量的热
C.元素X的气态氢化物的沸点高于元素W的气态氢化物的沸点
D.元素Z是一种较活泼的金属元素,可用铝热法从Z的氧化物中制备Z的单质
难度: 中等查看答案及解析
-
已知25 ℃、101 kPa下,下列反应
C(石墨) + O2(g) === CO2(g) ,燃烧1 mol C(石墨)放热393.51 kJ。
C(金刚石) + O2(g) === CO2(g),燃烧1 mol C(金刚石)放热395.41 kJ。可以得出的结论是
A.金刚石比石墨稳定 B.1 mol石墨所具有的能量比1 mol金刚石低
C.金刚石转变成石墨是物理变化 D.石墨和金刚石都是碳的同位素
难度: 中等查看答案及解析
-
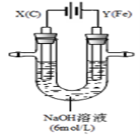
如右图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中。下列分析正确的是
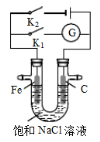
A.K1闭合,铁棒上发生的反应为2H++2e-→H2↑
B.K1闭合,石墨棒周围溶液pH逐渐降低
C.K2闭合,铁棒不会被腐蚀,属于外加电流的阴极保护法
D.K2闭合,电路中通过0.4NA个电子时,两极共产生4.48L气体
难度: 困难查看答案及解析
-
X、Y、Z、W四种短周期元素,有关数据如下表:
下列叙述正确的是
元素代号
X
Y
Z
W
原子半径/pm
66
70
143
160
主要化合价
-2
+5、+3、-3
+3
+2
A.W和Y形成的化合物中含有离子键和非极性键
B.一定条件下,X单质可以将Y单质从其氢化物中置换出来
C.Z的最高价氧化物能溶于氨水
D.Y的简单气态氢化物的沸点高于 X的简单气态氢化物
难度: 中等查看答案及解析
-
下列有关反应能量变化图像的判断错误的是
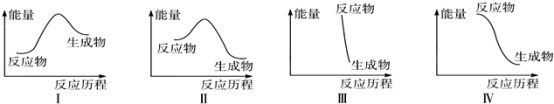
A.I可表示需加热的放热反应 B.Ⅱ可表示需加热的放热反应
C.Ⅲ可表示爆炸反应 D.Ⅳ可表示酸和碱的中和反应
难度: 中等查看答案及解析
-
下列说法不正确的是
①质子数相同的粒子一定是同种元素
②同位素的性质几乎完全相同
③质子数相同,电子数也相同的两种粒子,不可能是一种分子和一种离子
④电子数相同的粒子不一定是同一种元素
⑤一种元素只能有一种质量数
⑥某种元素的相对原子质量取整数,就是其质量数
A.②③⑤⑥ B.①②④⑤ C.①②⑤⑥ D.③④⑤⑥
难度: 中等查看答案及解析
-
下列有关反应热的叙述中正确的是
①已知2H2(g)+O2(g)=== 2H2O(g) ΔH=-483.6 kJ·mol-1,则氢气的燃烧热为△H=-241.8 kJ·mol-1
②由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定
③X(g)+Y(g)
Z(g)+W(s) ΔH>0,恒温恒容条件下达到平衡后加入X,上述反应的ΔH增大
④已知:
共价键
C—C
C===C
C—H
H—H
键能/(kJ·mol-1)
348
610
413
436
上表数据可以计算出
 的焓变
的焓变⑤根据盖斯定律,推知在相同条件下,金刚石或石墨燃烧生成1 mol CO2固体时,放出的热量相等
⑥25℃,101 kPa时,1 mol碳完全燃烧生成CO2所放出的热量为碳的燃烧热
A.①②③④ B.③④⑤ C.④⑤ D.⑥
难度: 困难查看答案及解析
-
太阳能的开发和利用是21世纪一个重要课题。利用储能介质储存太阳能的原理是:白天在太阳照射下某种盐熔化,吸收热量,晚间熔盐固化释放出相应的能量,已知数据:
盐
熔点(℃)
熔化吸热(kJ·mol-1)
参考价格(元·t-1)
CaCl2·6H2O
29.9
37.3
780~850
Na2SO4·10H2O
32.4
77.0
800~900
Na2HPO4·12H2O
35.1
100.1
1 600~2 000
Na2S2O3·5H2O
45.0
49.7
1 400~1 800
其中最适宜选用作为储能介质的是
A.CaCl2·6H2O B.Na2SO4·10H2O
C.Na2HPO4·12H2O D.Na2S2O3·5H2O
难度: 中等查看答案及解析
-
右图装置中,U型管内为红墨水,a、b试管内分别盛有食盐水和氯化氢溶液,各加入生铁块,放置一段时间。下列有关描述错误的是
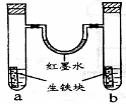
A.生铁块中的碳是原电池的正极
B.红墨水柱两边的液面变为左低右高
C.两试管中负极电极反应相同
D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
难度: 中等查看答案及解析
-
微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是
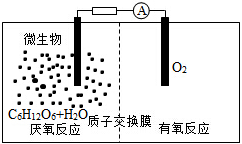
A.正极反应中有CO2生成
B.微生物促进了反应中电子的转移
C.质子通过交换膜从负极区移向正极区
D.电池总反应为C6H12O6+6O2=6CO2+6H2O
难度: 中等查看答案及解析
-
关于下列各装置图的叙述中,正确的是
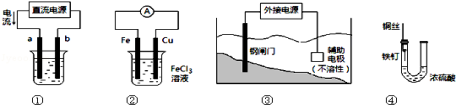
A.用装置①精炼铜,则b极为粗铜,电解质溶液为CuSO4溶液
B.装置②的总反应是:Cu+2Fe3+=Cu2++2Fe2+
C.装置③中钢闸门应与外接电源的正极相连
D.装置④中的铁钉几乎没被腐蚀
难度: 中等查看答案及解析
-
下列图示关系中不正确的是
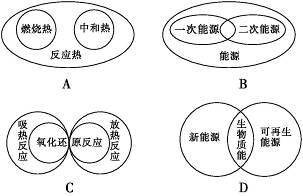
难度: 简单查看答案及解析
-
将0.2moLAgNO3、0.4moLCu(NO3)2、0.6moLKCl溶于水,配成100mL的溶液,用石墨做电极电解一段时间后,在一极析出0.3moLCu,此时在另一极收集到气体体积为(标况)( )
A. 4.48L B. 5.6L C. 6.72L D.7.84L
难度: 简单查看答案及解析
-
以熔融Li2CO3和K2CO3为电解质,天然气经重整催化作用提供反应气的燃料电池如右图。下列说法正确的是
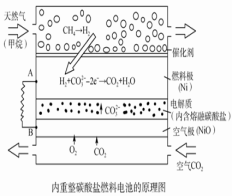
A.以此电池为电源电解精炼铜,当有0.1 mol e- 转移时,有3.2 g铜溶解
B.若以甲烷为燃料气时负极电极反应式:CH4+5O2--8e-=CO32-+2H2O
C.该电池使用过程中需补充Li2CO3和K2CO3
D.空气极发生的电极反应式为O2+4e-+2CO2===2CO32-
难度: 简单查看答案及解析
-
如图所示,甲池的总反应式为2CH3OH+3O2+4KOH===2K2CO3+6H2O。
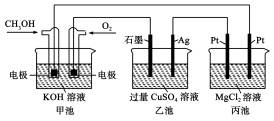
下列说法正确的是
A.甲池是电能转化为化学能的装置,乙、丙池是化学能转化为电能的装置
B.甲池通入CH3OH的电极反应式为CH3OH-6e-+2H2O===CO32-+8H+
C.反应一段时间后,向乙池中加入一定量Cu(OH)2固体,能使CuSO4溶液恢复到原浓度
D.甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上产生1.45 g固体
难度: 简单查看答案及解析