-
下列热化学方程式表达正确的是
A.S(s)+O2(g)= SO2(g);△H=-269.8kJ/mol
B.中和热的热化学方程式:NaOH(aq)+HCl(aq)= NaCl(aq)+H2O(l);△H=+57.3kJ/mol
C.燃烧热的热化学方程式:
C2H5OH(l)+3O2(g)= 2CO2(g)+3H2O(g);△H=-1367.0 kJ/mol
D.2NO2 = O2+2NO;△H = +116.2kJ/mol
难度: 简单查看答案及解析
-
下列物质与常用危险化学品的类别不对应的是
A.H2SO4、NaOH—腐蚀品 B.CH4、C2H4—易燃液体
C.CaC2、Na—遇湿易燃品 D.KMnO4、K2Cr2O7—氧化剂
难度: 简单查看答案及解析
-
下列叙述不正确的是
A.原电池是将化学能转化为电能的装置
B.铁船底镶嵌锌块,锌作负极,以防船体被腐蚀
C.钢铁腐蚀的正极反应:Fe-3e-=Fe3+
D.工业上电解饱和食盐水的阳极反应:2Cl--2e-=Cl2↑
难度: 简单查看答案及解析
-
下列实验操作或实验事故的处理合理的是:
A.用25mL的碱式滴定管量取14.80mL的酸性KMnO4溶液
B.实验时手指不小心沾上苯酚时,立即用70℃以上的热水清洗
C.用坩埚灼烧固体后应该立即放在石棉网上冷却至室温
D.用10mL量筒量取5.2mL盐酸
难度: 简单查看答案及解析
-
某混合溶液中只含有两种溶质NaCl和H2SO4,且n(NaCl): n(H2SO4)=3: 1。若以石墨电极电解该溶液,下列推断中不正确的是
A.阴极产物为H2 B.阳极先析出Cl2,后析出O2
C.电解液的pH不断增大,最终大于7 D.整个电解的过程实质是电解水
难度: 简单查看答案及解析
-
用惰性电极电解下列溶液,一段时间后,再加入一定质量的另一物质中(括号内),溶液能与原来溶液完全一样的是
A.CuSO4 [Cu(OH)2] B.NaOH [NaOH] C.NaCl [盐酸] D.AgNO3 [Ag2O]
难度: 简单查看答案及解析
-
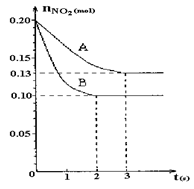
已知:CO2(g) + 3H2(g)
CH3OH(g) + H2O(g) ΔH =-49.0 kJ•mol-1。一定条件下,向体积为1 L的密闭容器中充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中,正确的是
A.升高温度能使
增大
B.反应达到平衡状态时,CO2的平衡转化率为75%
C.3 min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率
D.从反应开始到平衡,H2的平均反应速率υ(H2)=0.075 mol•L-1•min-1
难度: 简单查看答案及解析
-
根据碘与氢气反应的热化学方程式
(i)I2(g)+ H2(g)
2HI(g)ΔH = -9.48 kJ·mol-1
(ii) I2(s)+ H2(g)
2HI(g)ΔH = +26.48 kJ·mol-1,下列判断正确的是
A.254g I2(g)中通入2gH2(g),反应放热9.48 kJ
B.1 mol固态碘与1mol气态碘所含的能量相差17.00 kJ
C.反应(i)的产物比反应(ii)的产物稳定
D.反应(ii)的反应物总能量比反应(i)的反应物总能量低
难度: 简单查看答案及解析
-
下列叙述正确的是
A.无论是纯水,还是酸性、碱性或中性稀溶液,在常温下,其c(H+)×c(OH-)=1×10-14
B.c(H+)等于1×10-7 mol/L的溶液一定是中性溶液
C.0.2 mol/L CH3COOH溶液中的c(H+)是0.1 mol/L CH3COOH溶液中的c(H+)的2倍
D.强电解质的水溶液中不存在电解质分子
难度: 简单查看答案及解析
-
室温下向10mL pH=3的醋酸溶液中加入水稀释后,下列说法正确的是
A.溶液中导电粒子的数目减少
B.溶液中
不变
C.醋酸的电离程度增大,c(H+)亦增大
D.完全中和醋酸需加入10mLpH=11的NaOH溶液
难度: 简单查看答案及解析
-
下列事实不能用勒夏特列原理解释的是
A.收集氯气用排饱和食盐水的方法
B.加催化剂,使N2和H2在一定的条件下转化为NH3
C.可用浓氨水和氢氧化钠固体快速制取氨气
D.加压条件下有利于SO2和O2反应生成SO3
难度: 简单查看答案及解析
-
一种新型熔融盐燃料电池具有高发电效率。现用Li2CO3和Na2CO3的熔融盐混合物作电解质,一极通CO气体,另一极通O2和CO2混合气体,其总反应为:2CO+O2=2CO2。则下列说法正确的是
A.通CO的一极是电池的正极
B.熔融盐燃料电池中Na+移向电源负极
C.负极发生的电极反应是:CO+CO32--2e-=2CO2
D.正极发生氧化反应
难度: 简单查看答案及解析
-
根据下表提供的数据,判断在等浓度的NaClO、NaHCO3混合溶液中,各种离子浓度关系正确的是
化学式
电离常数
HClO
K=3×10-8
H2CO3
K1=4.3×10-7
K2=5.6×10-11
A.c(HCO3-)>c(ClO-)>c(OH-)
B.c(Na+)+c(H+)=c(HCO3-)+c(ClO-)+C(OH-)
C.c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)
D.c(Na+)=c(HCO3-)+ c(CO32-) + c(H2CO3) +c(ClO-) +c(HClO)
难度: 简单查看答案及解析
-
要求设计实验证明:某种盐的水解是吸热的,有四位同学分别作出如下回答,其中不正确的是
A.甲同学:将硝酸铵晶体溶液于水,若水温下降,说明硝酸铵水解是吸热的。
B.乙同学:用加热的方法可除去KNO3溶液中混有的Fe3+,说明含Fe3+的盐水解是吸热的。
C.丙同学:通过实验发现同浓度的热的纯碱液比冷的纯碱液去油污效果好,说明碳酸钠水解是吸热的。
D.丁同学:在醋酸钠溶液中滴入酚酞试液,加热(不考虑水的蒸发)后若红色加深,说明醋酸钠水解是吸热的。
难度: 简单查看答案及解析
-
已知25℃时,AgI饱和溶液中c(Ag+)为1.23×10-8mol/L,AgCl饱和溶液中c(Ag+)为1.25×10-5mol/L,若在5mL含有KCl、KI各为0.01mol/L的溶液中加入8mL0.01mol/LAgNO3溶液,则下列叙述正确的
A.混合溶液中c(K+)>c(NO3-)>c(Ag+)>c(Cl-)>c(I-)
B.混合溶液中c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-)
C.加入AgNO3溶液时首先生成AgCl沉淀
D.混合溶液中
约为1.02×10-3
难度: 简单查看答案及解析
-
以KCl和ZnCl2混合液为电镀液在铁制品上镀锌,下列说法正确的是
A.镀锌层破损后即对铁制品失去保护作用
B.未通电前上述电镀装置可构成原电池,电镀过程是该原电池的充电过程
C.电镀时保持电流恒定,升高温度不改变电解反应速率
D.因部分电能转化为热能,电镀时通过的电量与锌的析出量无确定关系
难度: 简单查看答案及解析
-
某种氢氧燃料电池的电解液为KOH溶液。下列有关电池的叙述不正确的是
A.负极反应式为:H2+2OH-—2e-==2 H2O
B.工作一段时间后,电解液中的KOH的物质的量不变
C.该燃料电池的总反应方程式为:2H2+O2==2H2O
D.用该电池电解CuCl2溶液,产生2.24LCl2(标准状况)时,有0.1mol电子转移
难度: 简单查看答案及解析
-
下列关于实验的误差分析不正确的是
A.用已经潮解的烧碱配制标准NaOH溶液,测得盐酸含量偏高
B.用浓硫酸配制一定物质的量浓度稀硫酸时,用量筒量取浓溶液的体积时仰视读数,所得溶液的浓度偏低
C.用盐酸滴定含Na2O的NaOH样品,所得结果偏高
D.用移液管取盐酸待测液时没有润洗,测得盐酸含量偏低
难度: 简单查看答案及解析
-
如图所示,杠杆AB两端分别持有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入较浓的硫酸铜溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中不考虑两球的浮力变化):
A.当杠杆为绝缘体时,A端高、B端低;为导体时,A端低、B端高
B.当杠杆为绝缘体时,A端低、B端高;为导体时,A端高、B端低
C.当杠杆为导体或绝缘体时,均为A端高B端低
D.当杠杆为导体或绝缘体时,均为A端低B端高
难度: 简单查看答案及解析
-
下列各组溶液中离子间一定能大量共存的是
A.pH=14的溶液中:K+、Al(OH)4-、SO42-
B.有Al3+存在的溶液中:Na+、HCO3-、F-
C.水电离出来的c(H+)=10-12mol·L-1的溶液中:K+、Cl-、SO32-
D.滴加甲基橙溶液显红色的溶液中:Ag+、NO2-、ClO3-
难度: 简单查看答案及解析
-
硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如下,下列说法正确的是

A.温度一定时,Ksp(SrSO4)随c(SO42-)的增大而减小
B.三个不同温度中,313K时Ksp(SrSO4)最大
C.283K时,图中a点对应的溶液是饱和溶液
D.283K下的SrSO4饱和溶液升温到363K后变为不饱和溶液
难度: 简单查看答案及解析
-
pH=11的x、y两种碱溶液各5mL,分别稀释至500mL,其pH与溶液体积(V)的关系如图所示,下列结论正确的是
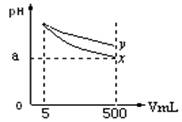
A.相同温度下,x的电离平衡常数小于y
B.若x、y是一元碱,等物质的量浓度的盐酸盐溶液,y的pH大
C.若x、y都是弱碱,则a的值一定大于9
D.完全中和x,y两溶液时,消耗同浓度稀硫酸的体积V(x)>V(y)
难度: 简单查看答案及解析