-
下面对氯气的叙述正确的是
A.氯气可使湿润的红布条褪色,所以氯气具有漂白性
B.氯气没有漂白性,但通入品红溶液中,品红褪色
C.过量的铜在氯气中燃烧可生成氯化亚铜
D.闻其气味时要小心的将集气瓶放在鼻孔下直接闻
难度: 简单查看答案及解析
-
(2013·广东惠州一模,7)下列有关化学与生活、生产的叙述错误的是
A.用作“钡餐”的物质的主要成分是硫酸钡
B.采用催化设施,将汽车尾气中的CO和NO转化为无害气体
C.常温下,可以用铁制容器来盛装冷的浓硫酸
D.SO2具有氧化性,可用于漂白纸浆
难度: 简单查看答案及解析
-
(2014乐山诊断)下列物质与其用途相符合的是
①Cl2——作消毒剂 ②AgBr——制胶卷,感光纸
③AgI——人工降雨 ④碘——预防甲状腺肿大
⑤淀粉——检验I2的存在 ⑥NaClO——漂白纺织物
A.只有②③④⑤⑥ B.只有①②③④⑤ C.只有②③④⑤ D.全部
难度: 简单查看答案及解析
-
下列能够检验出KI中是否含有Br-的实验是
A.加入足量的新制氯水,溶液变色则有Br-
B.加入酸性KMnO4溶液,观察溶液颜色是否褪去
C.加入少量的碘水,再加入CCl4振荡,有机层有色,则有Br-
D.加入足量FeCl3溶液,用CCl4萃取后,取无色的水层并加入氯水,溶液呈橙色,则含有Br-
难度: 中等查看答案及解析
-
下列各反应的离子方程式中,错误的是
A.硫酸铝溶液中加入过量的氨水:Al3++3NH3·H2O===Al(OH)3↓+3NH4+
B.铁片放入过量的稀硝酸中:3Fe+8H++2NO3-===3Fe2++2NO2↑+4H2O
C.将铝片放入过量NaOH溶液中:2Al+2OH-+2H2O===2AlO2-+3H2↑
D.偏铝酸钠与过量盐酸反应:AlO2-+4H+===Al3++2H2O
难度: 中等查看答案及解析
-
铁屑溶于过量稀硫酸,过滤后向滤液中加入过量氨水,有白色沉淀生成,过滤,在空气中加热沉淀至质量不再发生变化为止,得到红棕色残渣,上述沉淀和残渣分别是
A.Fe(OH)3 Fe2O3 B.Fe(OH)2 Fe2O3
C.Fe(OH)2 Fe(OH)3 D.Fe(OH)2 Fe3O4
难度: 中等查看答案及解析
-
已知氧化剂、稀酸等都能迅速破坏传染病毒活性而杀死病毒,下列物质不能作为常用消毒剂的是
A.H2O2溶液 B.NaClO溶液 C.SO2 D.醋酸
难度: 简单查看答案及解析
-
下列有关金属的说法正确的是
①纯铁不容易生锈②钠着火用水扑灭③铝在空气中耐腐蚀,所以铝是不活泼金属④缺钙会引起骨质疏松,缺铁会引起贫血 ⑤青铜、不锈钢、硬铝都是合金⑥KSCN溶液可以检验Fe3+
A.①④⑤⑥ B.②③④⑤ C.①③④⑤ D.①②⑤⑥
难度: 中等查看答案及解析
-
生活中常用氯气给自来水消毒。某学生用自来水配制下列物质的溶液,不会产生明显药品变质的是
A.石蕊 B.硝酸银 C.氢氧化钠 D.氯化铝
难度: 中等查看答案及解析
-
下列实验现象,与新制氯水中的某些成分(括号内物质)没有关系的是
A.将NaHCO3固体加入新制氯水,有无色气泡生成(H+)
B.使红色布条褪色(HClO)
C.向NaBr溶液中滴加氯水,再滴加CCl4,发现下层为橙红色(HCl)
D.滴加AgNO3溶液生成白色沉淀(Cl-)
难度: 中等查看答案及解析
-
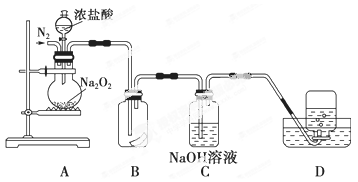
Na2O2是一种既有氧化性、又有还原性的物质,当Na2O2与某物质Q发生反应并且有氧气生成时,下列有关说法正确的是
A.Q一定是氧化剂 B.当有1 mol O2生成时转移电子4 mol
C.O2一定是氧化产物 D.Na2O2不可能发生还原反应
难度: 中等查看答案及解析
-
下列有关金属及其化合物的说法正确的是
A.Mg和Al都可以用电解法冶炼得到
B.Na2O和Na2O2与CO2反应产物相同
C.MgO和Al2O3均只能与酸反应,不能与碱反应
D.Mg和Fe在一定条件下与水反应都生成H2和对应的碱
难度: 中等查看答案及解析
-
在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如右图所示,则原混合液中Al2(SO4)3与MgSO4的物质的量浓度之比为
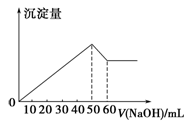
A.6∶1 B.3∶1 C.2∶1 D.1∶2
难度: 中等查看答案及解析
-
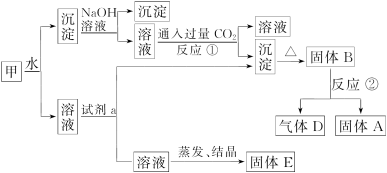
某纯碱厂技术科的人员对该厂纯碱样品的质量进行检验。其中能够说明纯碱样品中可能含有杂质(NaHCO3)的实验是
①样品溶于水,并加入足量的澄清石灰水,变浑浊
②样品溶于水,并加入足量的BaCl2溶液,变浑浊
③样品在硬质试管中加强热,排出的气体通入澄清石灰水,变浑浊
④向样品中滴加稀盐酸,排出的气体通入澄清石灰水,变浑浊
A.①②③ B.①③④ C.①②④ D.只有③
难度: 中等查看答案及解析
-
用如图所示装置进行下列实验,实验结果与预测的现象不一致的是
①中的物质
②中的物质
预测①的现象
A
淀粉KI溶液
浓硝酸
无明显变化
B
酚酞溶液
浓盐酸
无明显变化
C
AlCl3溶液
浓氨水
有白色沉淀
D
湿润红纸条
饱和氯水
红纸条褪色
难度: 中等查看答案及解析
-
下列各项操作中,不发生“先产生沉淀,然后沉淀又溶解”现象的是①向饱和碳酸钠溶液中通入过量的CO2;②向NaAlO2溶液中逐滴加入过量的稀盐酸;③向AlCl3溶液中逐滴加入过量的稀氢氧化钠溶液;④向硅酸钠溶液中逐滴加入过量的盐酸
A.①② B.①③ C.①④ D.②③
难度: 中等查看答案及解析
-
将X气体通入BaCl2溶液,未见沉淀生成,然后通入Y气体,有沉淀生成,X、Y不可能是
选项
X
Y
A
SO2
H2S
B
Cl2
CO2
C
NH3
CO2
D
SO2
Cl2
难度: 中等查看答案及解析
-
建筑用的红砖和青砖,其颜色是由其中含有的不同价态的铁氧化物所致。我国古代砖瓦建筑能够保持到现在的,几乎无一例外的是由青砖建成。有人提出以下可能的原因:
①青砖中含的是FeO;②青砖中含的是Fe3O4;③Fe2O3遇长期酸雨侵蚀会风化溶解使砖瓦强度降低;④Fe3O4性质稳定;⑤FeO性质稳定。你认为有道理的是
A.①③⑤ B.②③④ C.③⑤ D.①②③④⑤
难度: 中等查看答案及解析
-
已知:KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O。如图所示,将少量试剂分别放入培养皿中的相应位置,实验时将浓盐酸滴在KClO3晶体上,并用表面皿盖好。下表中由实验现象得出的结论完全正确的是
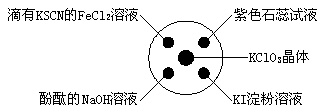
选项
实验现象
结论
A
滴有KSCN的FeCl2溶液变红
Cl2具有还原性
B
滴有酚酞的NaOH溶液褪色
Cl2具有酸性
C
紫色石蕊溶液先变红后褪色
Cl2具有漂白性
D
KI淀粉溶液变蓝色
Cl2具有氧化性
难度: 中等查看答案及解析
-
金属Ti(钛)是一种具有许多优良性能的较为昂贵的金属,钛和钛合金被认为是21世纪的重要金属材料。某化学兴趣小组用实验探究Ti、Mg、Cu的活泼性顺序。他们在相同温度下,取大小相同的三种金属薄片,分别投入等体积等浓度的足量稀盐酸中,观察现象如下:
金属
Ti
Mg
Cu
金属表面现象
放出气泡速度缓慢
放出气泡速度快
无变化
下列有关三种金属的说法正确的是
A.三种金属的活泼性由强到弱的顺序是Ti、Mg、Cu
B.若钛粉中混有Mg,提纯Ti时可用稀盐酸除去Mg
C.用Ti从CuSO4溶液中置换出Cu是工业制取Cu的很好途径
D.Cu和稀盐酸不发生化学反应
难度: 中等查看答案及解析
-
为了证明硫酸亚铁铵[(NH4)2Fe(SO4)·26H2O]晶体的成分中含有NH4+、Fe2+、SO42-和H2O,下列实验叙述中不正确的是
A.取少量硫酸亚铁铵晶体放入试管中,加热,试管口有液体生成,则可证明晶体的成分中含有结晶水
B.取少量硫酸亚铁铵晶体放入试管,加浓NaOH溶液,加热,试管口湿润的蓝色石蕊试纸变红,则可证明晶体的成分中含有NH4+
C.取适量硫酸亚铁铵晶体溶于水,加少量稀盐酸,无现象,再滴入几滴BaCl2溶液,有白色沉淀生成,则可证明晶体的成分中含有SO42-
D.取适量硫酸亚铁铵晶体溶于水,得浅绿色溶液,滴入2滴KSCN溶液,溶液不显血红色,再滴入几滴新制氯水,溶液变为血红色,则可证明晶体的成分中含有Fe2+
难度: 中等查看答案及解析