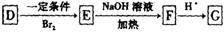-
太阳能光伏发电系统是被称为“21世纪绿色光源”的半导体照明(LED)系统(如下图)。已知发出白光的LED是将GaN芯片和钇铝石榴石(YAG,化学式:Y3Al5O12)芯片封装在一起做成。下列说法中正确的是( )
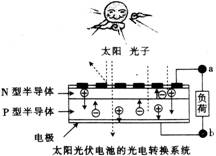
A.光伏发电是将电能转变为太阳能
B.右图中N型半导体为负极,P型半导体为正极,电流从a流向b
C.YAG中钇显+3价
D.31Ga与N位于元素周期表的同一主族
难度: 简单查看答案及解析
-
下列表述中,合理的是( )
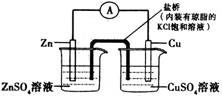
A.把SO2通入品红试液,可验证SO2水溶液的酸性
B.构成如右图所示装置时,盐桥中的K+移向ZnSO4溶液
C.配制一定物质的量浓度的溶液,定容时俯视容量瓶的刻度线,会使所配溶液的浓度偏低
D.已知:
则
难度: 简单查看答案及解析
-
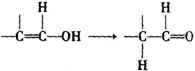
丁子香酚可用于配制康乃馨型香精及制作杀虫剂和防腐剂,结构简式如右图。下列物质在一定条件下不能跟丁子香酚反应的是( )
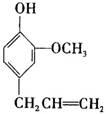
A.NaOH溶液 B.NaHCO3溶液
C.FeCl3溶液 D.Br2的CCl4溶液
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A.25℃时,PH=13的1.0L Ba(OH)2溶液中含有的OH-数目为0.2NA
B.标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA
C.室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为l.5NA
D.12g金刚石含共价键的个数是2 mol
难度: 简单查看答案及解析
-
右图表示反应
的正反应速率随时间的变化情况,由此曲线判断下列说法中,可能正确的是( )
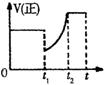
A.t1时减小了N2的浓度,增加了NH3的浓度
B.t2时降低了温度,平衡向正反应方向移动
C.t1时可能使用了催化剂
D.t1到t2时段内,逆反应速率增大
难度: 简单查看答案及解析
-
下列溶液中微粒的物质的量浓度关系正确的是( )
A.室温下,向
溶液中滴加
溶液至中性:
B.
溶液:
C.
溶液:
D.
的
溶液中:
难度: 简单查看答案及解析
-
如右图为元素周期表中短周期的一部分,关于Y、Z、M的说法正确的是( )
A.非金属性:
B.离子半径:
C.ZM2分子中各原子的最外层均满足8电子稳定结构
D.三种元素中,Y的最高价氧化物对应的水化物酸性最强
难度: 简单查看答案及解析
-
用碳棒电极电解一定质量的某浓度的氯化钾溶液,一段时间后停止电解。此时若加入100g 36.5%的浓盐酸,所得溶液正好与原溶液完全相同,则电解过程中转移电子的物质的量约为( )
A.9 mol B.7 mol C.6 mol D.8 mol
难度: 简单查看答案及解析