-
已知33As、35Br位于同一周期,下列关系正确的是
A. 原子半径:As>C1>P B. 热稳定性:HC1>AsH3>HBr
C. 还原性:As3->S2->C1- D. 酸性:H3AsO4>H2SO4>H3PO4
难度: 中等查看答案及解析
-
对于化学反应3W(g)+2X(g)=4Y(g)+3Z(g),下列反应速率关系中,正确的是
A. υ(W)=3υ(Z) B. 2υ(X)=3υ(Z) C. 2υ(X)="v(Y)" D. 3υ(W)=2υ(X)
难度: 简单查看答案及解析
-
下列化学用语正确的是
A. CO2的电子式是
B. 硫的原子结构示意图是

C.
表示中子数是18的氧原子 D. 氮气的结构式是 N≡N
难度: 简单查看答案及解析
-
依据元素周期表及元素周期律,下列推断正确的是
A. 碱性:Ca(OH)2 >Mg(OH)2 B. 酸性:H2SO3 > H2CO3
C. 热稳定性:NH3 < PH3 D. 还原性:S2- < F-
难度: 中等查看答案及解析
-
下列关于元素周期表应用的说法正确的是
A. 在过渡元素中,可以找到半导体材料
B. 在ⅠA、ⅡA族元素中,寻找制造农药的主要元素
C. 在金属与非金属的交界处,寻找耐高温、耐腐蚀的合金材料
D. 为元素性质的系统研究提供指导,为新元素的发现提供线索
难度: 简单查看答案及解析
-
下列过程与化学键断裂有关的是
A. 二氧化碳气体变为干冰 B. 熔融氯化钠导电
C. 碘升华 D. 酒精溶解于水
难度: 中等查看答案及解析
-
下列反应是吸热反应的是
A. 镁条与稀H2SO4反应 B. Ba(OH)2·8H2O与NH4Cl的反应
C. 氢氧化钠溶液和稀盐酸反应 D. 甲烷在O2中的燃烧反应
难度: 简单查看答案及解析
-
现有如下实验方案中,可以达到相应实验目的的是
A
B
C
D
方
案
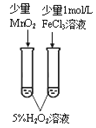
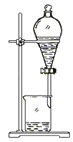
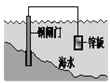
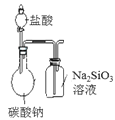
目
的
验证不同催化剂对化学反应速率的影响
分离乙醇和水
将锌板换成铜板
对钢闸门保护效果更好
已知:Na2SiO3 + CO2 + H2O == Na2CO3 + H2SiO3↓
验证非金属性:C > Si
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
短周期元素W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21。下列关系正确的是
A. 氢化物热稳定性:W<X
B. 最高价氧化物对应水化物的酸性:W<Y
C. Z、W的氢化物的水溶液都呈酸性
D. 简单离子的半径:Y>Z
难度: 中等查看答案及解析
-
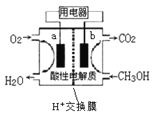
关于下图所示的原电池,下列说法不正确的是
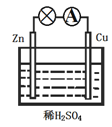
A. 该装置能将化学能转化为电能
B. Zn为负极,发生氧化反应
C. 正极的反应为 2H+ + 2e- =H2↑
D. 电子由铜片通过导线流向锌片
难度: 简单查看答案及解析
-
2008年北京奥运会的 “祥云”火炬所用燃料的主要成分是丙烷,下列有关丙烷的叙述正确的是
A. 丙烷的分子式是C3H6
B. 丙烷分子中的碳原子在一条直线上
C. 丙烷在光照条件下能够与氯气发生取代反应
D. 丙烷的沸点比乙烷低
难度: 简单查看答案及解析
-
NA表示阿伏加德罗常数的值,下列叙述正确的是
A. 18 g D2O所含的电子数为10NA
B. 1 mol H2O2中含有极性键的数目为3NA
C. 标准状况下,22.4 L四氯化碳所含分子数为NA
D. 32g O2和O3的混合物中含有的氧原子数为2NA
难度: 中等查看答案及解析
-
根据元素周期律,由下列事实进行归纳推测,推测不合理的是( )
选项
事实
推测
A
12Mg与水反应缓慢,20Ca与水反应较快
56Ba(第ⅡA族)与水反应会更快
B
Si是半导体材料,同族的Ge也是半导体材料
第ⅣA族的元素的单质都可作半导体材料
C
HCl在1 500 ℃时分解,HI在230 ℃时分解
HBr的分解温度介于二者之间
D
Si与H2高温时反应,S与H2加热能反应
P与H2在高温时能反应
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
根据下列事实:①X+Y2+=X2++Y;②Z+H2O(冷)=Z(OH)2+H2↑;③Z2+氧化性比X2+弱;④由Y、W电极组成的电池,电极反应为W2++2e-=W、Y-2e-=Y2+,可知X、Y、Z、W的还原性由强到弱的顺序为 ( )
A. X > Z > Y > W B. Z > W > X > Y
C. Z > Y > X > W D. Z > X > Y > W
难度: 中等查看答案及解析
-
下列措施能明显增大原反应的化学反应速率的是
A. C(s)+ CO2
2CO反应中,增大C的量
B. 将稀H2SO4改为98%的浓H2SO4与Zn反应制取H2
C. 在H2SO4与NaOH两溶液反应时,增大压强
D. 恒温恒容条件下,在工业合成氨反应中,增加氮气的量
难度: 中等查看答案及解析
-
在一定温度下,可逆反应X(g)+ 3Y(g)
2Z(g)达到平衡的标志是
A. Z生成的速率与X消耗的速率相等
B. 单位时间生成a mol X,同时生成3a mol Y
C. X、Y、Z的浓度不再变化
D. X、Y、Z的分子数比为1∶3∶2
难度: 中等查看答案及解析
-
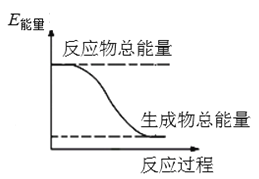
H2在Cl2中燃烧的方程式为:H2 + Cl2
2HCl,已知在相同条件下,有下图所示的能量变化,下列说法中正确的是
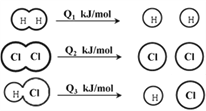
A. H2、Cl2和HCl分子中的化学键都是非极性共价键
B. 1 mol H2与1 mol Cl2的总能量小于2 mol HCl的总能量
C. 1molH2与1molCl2反应生成2 mol HCl时,反应放出的能量为:2Q3-Q1 -Q2
D. 1molH2与1molCl2反应生成2 mol HCl的过程中:Q1+ Q2 >2Q3
难度: 中等查看答案及解析
-
纽扣电池的两极材料分别为锌和氧化银,电解质溶液为KOH溶液。放电时两个电极反应分别为:Zn+2OH-- 2e- == Zn(OH)2 ,Ag2O+H2O+2e- == 2Ag + 2OH-。下列说法正确的是
A. Zn发生还原反应,Ag2O发生氧化反应
B. 溶液中OH-向正极移动,K+、H+向负极移动
C. 在电池放电过程中,KOH溶液的浓度保持不变
D. Zn是负极,氧化银是正极
难度: 中等查看答案及解析
-
Fe和Mg与H2SO4反应的实验记录如下:
实验
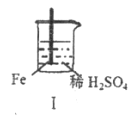
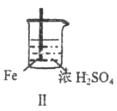
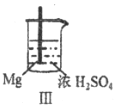

现象
Fe表面产生大量无色气泡
Fe表面产生少量气泡后迅速停止
Mg表面迅速产生大量气泡
Fe表面有大量气泡,Mg表面有少量气泡
关于上述实验说法不合理的是
A. Ⅰ中产生气体的原因是:Fe+2H+=Fe2++H2↑
B. 取出Ⅱ中的铁棒放入CuSO4溶液立即析出亮红色固体
C. Ⅲ中现象说明Mg在浓H2SO4中没被钝化
D. Ⅳ中现象说明Mg的金属性比Fe强
难度: 中等查看答案及解析
-
在一定条件下,将3 mol A和1 mol B两种气体混合于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g)
xC(g)+2D(g)。2 min末该反应达到平衡,测得生成0.8 mol D, 0.4 mol C。下列判断不正确的是
A. x =1
B. 2 min时,A的浓度为0.9mol·L-1
C. 2 min内A的反应速率为0.3 mol·L-1·min-1
D. B的转化率为60%
难度: 困难查看答案及解析
 E.
E.