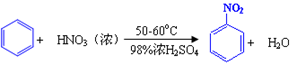
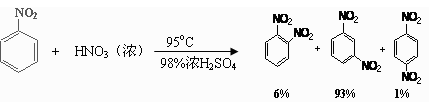
-
节约资源和保护环境是每个公民应尽的义务。下列说法错误的是
A.废弃的金属、纸制品、塑料是可回收资源,玻璃不是可回收资源
B.大力推广农作物的生物防治技术,以减少农药的使用
C.“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”都能提高空气质量
D.“低碳生活”倡导生活中耗用能量尽量减少从而减少CO2排放
难度: 中等查看答案及解析
-
以下进行性质比较的实验,不合理的是
A.比较镁、铝金属性:氯化镁、氯化铝溶液中分别加入过量的NaOH溶液
B.比较氯、溴非金属性:溴化钠溶液中通入氯气
C.比较Cu、Fe2+的还原性:铁加入硫酸铜溶液中
D.比较高锰酸钾、氯气的氧化性:高锰酸钾中加入浓盐酸
难度: 中等查看答案及解析
-
中学化学实验中常用到碳酸钠溶液,下列有关叙述错误的是
A.在实验室中,能用碳酸钠溶液制备少量烧碱
B.实验室制CO2气体时,用饱和碳酸钠溶液除去其中混有的HCl气体
C.制取乙酸丁酯时,用于除去混有的丁醇和乙酸
D.做银镜反应实验时,可用热的碳酸钠溶液洗涤掉反应前试管内壁上的油污
难度: 中等查看答案及解析
-
莽草酸可用于合成药物达菲,其结构简式如图,下列关于莽草酸的说法正确的是
A.分子式为C7H6O5 B.分子中含有两种官能团
C.可发生加成和取代反应 D.在水溶液中羟基和羧基均能电离出氢离子
难度: 中等查看答案及解析
-
由—CH3、
、—OH、—COOH四种原子团两两组合形成的有机物中,属于弱电解质的有
A.3种 B.4种 C.5种 D.6种
难度: 中等查看答案及解析
-
下列说法不正确的是
A.Ksp只与难溶电解质的性质和温度有关
B.由于Ksp(ZnS)>Ksp(CuS),所以ZnS沉淀在一定条件下可转化为CuS沉淀
C.其他条件不变,离子浓度改变时,Ksp不变
D.两种难溶电解质作比较时,Ksp小的,溶解度一定小
难度: 中等查看答案及解析
-
高温下,某反应达平衡,化学平衡常数表达式为:
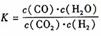 ,恒容时,温度升高H2浓度减小。下列说法正确的是
,恒容时,温度升高H2浓度减小。下列说法正确的是A.该反应化学方程式为:CO(g)+H2O(g)
CO2(g)+H2(g)
B.恒温恒容下,反应达平衡时,再通入一定量的CO2,CO的体积分数一定增大
C.升高温度,正反应速率增大,逆反应速率减小
D.该反应的焓变为正值
难度: 中等查看答案及解析
-
下列有关物质的性质与应用不相对应的是
A.二氧化硫具有漂白性,可用于漂白纸浆 B.常温下,铝能被浓硫酸钝化,可用铝罐贮运浓硫酸
C.MgO熔点很高,可用于制作耐火材料 D.氢氟酸具有弱酸性,可用于蚀刻玻璃
难度: 中等查看答案及解析
-
已知:H2(g)+
O2(g)=H2O(l) ΔH1=-285.8 kJ·mol-1 ①
H2(g)=H2(l) ΔH2=-0.92 kJ·mol-1 ② O2(g)=O2(l) ΔH3=-6.84 kJ·mol-1 ③
H2O(g)=H2O(l) ΔH4=-44 kJ·mol-1 ④
下列说法正确的是
A.上述四个反应都是吸热反应
B.1 mol液态H2的能量大于1 mol气态H2的能量
C.H2的燃烧热(ΔH)为-285.8 kJ·mol-1
D.火箭中液氢燃烧的热化学方程式为H2(l)+
O2(l)=H2O(g) ΔH=-285.8 kJ·mol-1
难度: 中等查看答案及解析
-
某含Na+的溶液中可能含有NH4+、Fe3+、Br—、CO32—、I—、SO32—。取样,滴加足量氯水,有气泡产生,溶液呈橙色;向橙色溶液中加BaCl2溶液或淀粉均无现象。为确定该溶液的组成,还需进行的实验有
A.取样,滴加硫氰化钾溶液
B.取样,加氯水和CCl4,振荡
C.取样,加足量盐酸加热,湿润的品红试纸检验气体
D.取样,加足量的熟石灰加热,湿润的红色石蕊试纸检验气体
难度: 中等查看答案及解析
-
在下列给定条件的溶液中,一定能大量共存的离子组是
A.澄清透明溶液:H+、Na+、SO42-、C6H5O-
B.常温下Kw/c(H+)=0.1 mol/L的溶液:K+、Na+、SiO32-、NO3-
C.铁片加入产生气泡的溶液:Na+、NH4+、I-、NO2-
D.NaHCO3溶液:K+、Na+、SO42-、Al3+
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列叙述中一定正确的是
A.一定条件下某密闭容器盛有0.1 mol N2和0.3 mol H2,充分反应后转移电子数为0.6NA
B.50mL18.4 mol·L-1浓硫酸与足量铜加热反应,生成SO2的分子数为0.46NA
C.一定条件下4.6g Na完全与O2反应生成7.2 g产物,失去的电子数为0.2NA
D.电解1L NaCl溶液至c(OH-) = 0.2 mol·L -1,转移电子数为0.4NA(假设电解过程中溶液体积不变)
难度: 中等查看答案及解析
-
根据右下表数据,下列判断正确的是
物质
HF
H3PO4
电离平
衡常数
K= 3.6×10—4
K1= 7.5×10—3
K2= 6.2×10—8
K3= 2.2×10—13
A.在等浓度的NaF、NaH2PO4混合溶液中,c(Na+)+c(H+)=c(F-)+ c(H2PO4-)+ c(OH-)
B.少量H3PO4和NaF反应的离子方程式为:H3PO4 +F-=H2PO4-+HF
C.同温同浓度时,溶液的pH:NaF>NaH2PO4>Na2HPO4
D.结合H+ 的能力:F—>HPO42—>PO43—
难度: 中等查看答案及解析
-
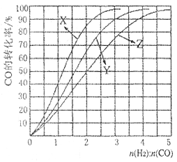
下列图示与对应的叙述相符的是
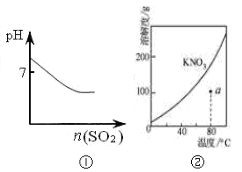
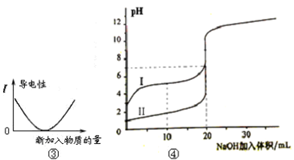
A.图①可表示将SO2气体通入溴水时pH的变化
B.图②表示KNO3的溶解度曲线,a点是80 ℃的KNO3的不饱和溶液
C.图③表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
D.图④表示室温下,0.100 mol/L NaOH 溶液分别滴定0.100 mol/L的盐酸和醋酸的滴定曲线,由图知Ⅰ为盐酸的滴定曲线。
难度: 中等查看答案及解析
-
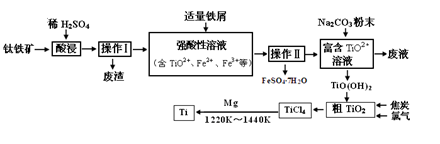
工业废水中常含有一定量的Cr2O72—和CrO42—,它们会对人类及生态系统产生很大的伤害,必须进行处理。该法的工艺流程为
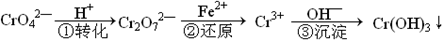
其中第①步存在平衡:2CrO42—(黄色)+2H+
Cr2O72—(橙色)+H2O下列说法错误的是
A.在第①反应平衡体系中加入水,溶液中c(H+)增大
B.溶液的pH值不变时,说明第①步反应达平衡状态
C.第②步中,还原0.01mol Cr2O72—离子,需要0.06mol的FeSO4·7H2O。
D.上述三步转化反应中,只有一个反应为氧化还原反应
难度: 中等查看答案及解析
-
中科院化学所研制的晶体材料——纳米四氧化三铁,在核磁共振造影及医药上有广泛用途其生产过程的部分流程如下图所示。
纳米四氧化三铁。下列有关叙述不合理的是
A.纳米四氧化三铁可分散在水中,它与FeCl3溶液的分散质直径相当
B.纳米四氧化三铁具有磁性,可作为药物载体用于治疗疾病
C.在反应①中环丙胺的作用可能是促进氯化铁水解
D.反应②的化学方程式是6FeOOH+CO=2Fe3O4+3H2O十CO2
难度: 中等查看答案及解析
-
PASS是新一代高效净水剂,它由X、Y、Z、W、R五种短周期元素组成,五种元素原子序数依次增大。X原子是所有原子中半径最小的,Y、R同主族,Z、W、R同周期,Y原子的最外层电子数是次外层的3倍,Z是常见的金属,电子层数等于主族序数,W单质是人类将太阳能转变为电能的常用材料。下列说法正确的是
A.Z与Y形成的化合物可作为耐高温材料
B.WY2能与碱反应,但不能与任何酸反应
C.原子半径按X、Y、Z、R、W的顺序依次增大
D.熔沸点:X2R>X2Y
难度: 中等查看答案及解析
-
下列离子方程式中正确的是
A.用Pt电极电解少量的CuCl2溶液:2H2O+Cu2++2Cl-
H2↑+Cl2↑+Cu(OH)2↓
B.0.01 mol/L NH4Al(SO4)2溶液与0.02 mol/L Ba(OH)2溶液等体积混合
NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3·H2O
C.酸性高锰酸钾溶液中滴加H2O2溶液4H2O2+ 4MnO4-+ 12H+ = 4 Mn2+ + 10 H2O + 7O2↑
D.向磁性氧化铁中加入氢碘酸:Fe3O4 +8H+=Fe2+ +2 Fe3+ +4H2O
难度: 中等查看答案及解析
-
如图是一种可充电的锂离子电池充、放电的工作示意图。该电池的反应式为:LiMnO2 + C6
Li1-x MnO2 + LixC6 (LixC6表示锂原子嵌入石墨形成的复合材料)下列有关说法正确的是
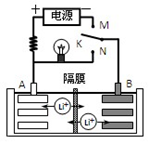
A.K与N相接时,A极为负极,该电极反应式为:LixC6 - xeˉ= C6 + xLi+
B.在整个充电或放电过程中都只存在一种形式的能量转化
C.K与N相接时,Li+由A极区迁移到B极区
D.K与M相接时,A极发生氧化反应,LiMnO2 -xeˉ = Li1-xMnO2 + xLi+
难度: 中等查看答案及解析
-
一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体VL(标准状况),向反应后的溶液中(存在Cu2+和SO42-)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 12.0 g,若上述气体为NO和NO2的混合物,且体积比为1﹕1,则V可能为
A.135 L B.90 L C.168 L D.157 L
难度: 中等查看答案及解析