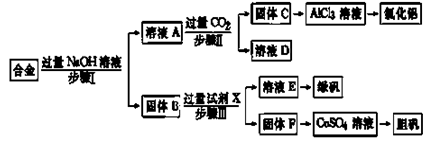
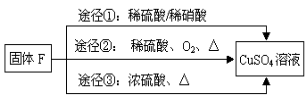
-
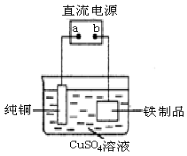
化学与人类生活、社会可持续发展密切相关,下列措施有利于节能减排、保护环境的是
①加快化石燃料的开采与使用;②研发易降解的生物农药;③应用高效洁净的能源转换技术;④田间焚烧秸秆;⑤推广使用节能环保材料;⑥2M+N=2P+2Q ,2P+M= Q
(M、N为原料,Q为期望产品),其中符合“化学反应的绿色化”的要求的是
A.①③④⑤ B.②③⑤⑥ C.①②③④ D.②④⑤⑥
难度: 中等查看答案及解析
-
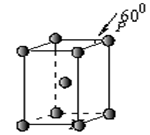
下列有关化学用语表示正确的是
A.苯甲醛:
B. Mg2+的结构示意图:
C.CO2的电子式:
D.核内有8个中子的碳原子:
C
难度: 中等查看答案及解析
-
常温下,在下列给定条件的各溶液中,一定能大量共存的离子组是
A.使酚酞变红色的溶液:Na+、Ba2+、I-、Cl-
B.使甲基橙变红色的溶液:Fe2+、K+、NO3-、SO42-
C.含有0.1 mol·L-1 Fe3+的溶液:Na+、K+、SCN-、NO
D.由水电离产生的c(H+)=10-12mol·L-1的溶液:NH4+、SO42-、HCO3-、Cl-
难度: 中等查看答案及解析
-
下列分子中指定的碳原子(用*标记)不属于手性碳原子的是( )
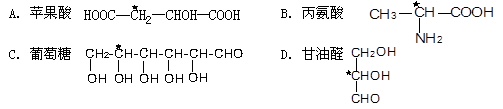
难度: 中等查看答案及解析
-
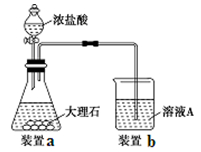
下列有关实验装置进行的相应实验,能达到实验目的的是
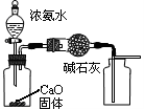
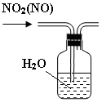
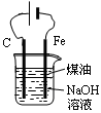
图1 图2 图3 图4
A.用图1装置制取并收集干燥纯净的NH3
B.用图2所示装置可除去NO2中的NO
C.用图3所示装置可分离CH3COOC2H5和饱和碳酸钠溶液
D.用图4装置制备Fe(OH)2并能较长时间观察其颜色
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的值。下列叙述正确的是
A.78gNa2O2固体中含有的阴离子数为NA
B.标准状况下,2.24L氖气所含原子数为0.2NA
C.1L 0.1 mol/L醋酸溶液中含有的氢离子数为0.1NA
D.标准状况下,2.24L己烷含有分子的数目为0.1NA
难度: 中等查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是
A.工业电解饱和食盐水:2Cl-+ H2O = Cl2↑+ H2↑+ OH-
B.碳酸钠的水【解析】
CO32-+ 2H2OH2CO3 + 2OH-
C.硫酸铝溶液中滴加过量浓氨水:Al3++4 NH3·H2O===AlO
+4NH4++2H2O
D.用过氧化氢从酸化海带灰浸出液中提取碘:2I-+ H2O2 +2H+ = I2 +2H2O
难度: 困难查看答案及解析
-
下列物质的转化在给定条件下能实现的是
①NaAlO2(aq)
AlCl3
Al ② NH3
NO
HNO3
③NaCl(饱和)
NaHCO3
Na2CO3 ④FeS2
SO3
H2SO4
A.②③ B.①④ C.②④ D.③④
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如
图所示。下列说法不正确的是
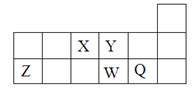
A.离子半径的大小顺序为:r(W2—)>r(Q—)>r(Y2—)>r(Z3+)
B.元素W的最高价氧化物对应水化物的酸性比Q的强
C.元素X的氢化物与Q的氢化物化合的产物中既含共价键又含离子键
D.X、Z、W、Q四种元素的最高价氧化物对应水化物均能与强碱反应
难度: 中等查看答案及解析
-
近年来高铁酸钾(K2FeO4)已经被广泛应用在水处理方面,高铁酸钾的氧化性超过高锰酸钾,是一种集氧化、吸附、凝聚、杀菌的新型高效的多功能水处理剂。高铁酸钾在水处理过程中涉及到的过程正确的有:
①蛋白质的变性 ②蛋白质的盐析 ③胶体的聚沉 ④盐类水解 ⑤焰色反应 ⑥氧化还原反应
A.①②③④ B.①③④⑥ C.②③④⑤ D.②③⑤⑥
难度: 中等查看答案及解析
-
下列说法正确的是
A.反应CaCO3(s)=CaO(s)+CO2(g)在常温下不能发生,则该反应的△H>0
B.0.1 mol·L-1CH3COOH溶液加水稀释后,溶液中
的值减小
C.铅蓄电池在放电过程中,负极质量增加,正极质量减少
D.锅炉中沉积的CaSO4可用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除
难度: 中等查看答案及解析
-
常温下,下列溶液中,有关微粒的物质的量浓度关系正确的是
A.0.1 mol·L-1 (NH4)2Fe(SO4)2溶液: c(NH
)> c(SO
)>c(Fe2+)>c(H+)
B.0.1 mol·L-1 Na2CO3溶液:c(Na+)+c(H+)=c(CO
)+c(HCO
)+c(OH-)
C.0.1 mol·L-1 NaHCO3溶液:c(H+)+2c(H2CO3)=c(OH-)+c(CO
)
D.0.01 mol·L-1NaOH溶液与等体积pH=2的醋酸混合后的溶液中:
c (CH3COO-) > c (Na+) > c (H+)> c (OH-)
难度: 困难查看答案及解析
-
下列物质分类的正确组合是
分类
组合
纯净物
酸
盐
碱性氧化物
酸性氧化物
A
碱石灰
乙二酸
纯碱
氧化铝
二氧化碳
B
盐酸
石炭酸
小苏打
氧化镁
二氧化氮
C
H2O2
硬脂酸
苏打
过氧化钠
二氧化硫
D
五水硫酸铜
油酸
碱式碳酸铜
氧化钠
三氧化硫
难度: 中等查看答案及解析
-
某元素的原子最外电子层排布是6s26p4,该元素或其化合物不可能具有的性质是
A.该元素单质可能是导体
B.该元素的最高化合价呈+6价
C.该元素能与氢气反应生成气态氢化物
D.该元素价电子轨道中有2个未成对电子
难度: 简单查看答案及解析
-
相同温度下,体积均为0.25L的两个恒容密闭容器中发生可逆反应:
X2(g)+3Y2(g)
2XY3(g) △H=-92.6kJ·mol-1
起始时各物质物质的量如下表所示:
容器
编号
起始时各物质物质的量/mol
X2
Y2
XY3
①
1
3
0
②
0.6
1.8
0.8
达到平衡后,①容器中XY3的物质的量为0.5mol。下列叙述正确的是
A.容器①、②中反应的平衡常数不相等
B.达平衡时,容器②中XY3的物质的量浓度为2mol·L—1
C.容器①中反应达到平衡时放出的热量为23.15 kJ
D.容器②中反应达到平衡时放出热量
难度: 中等查看答案及解析