-
(18分) A、B、C、D、E、F是周期表中的前20号元素,原子序数逐渐增大。A元素是宇宙中含量最丰富的元素,其原子的原子核内可能没有中子。B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相等;C元素原子最外层p能级比s能级多1个电子;D原子p轨道上成对电子数等于未成对电子数;E的常见化合价为+3;F最高正价与最低负价的代数和为4;G+的M层电子全充满。用化学式或化学符号回答下列问题:
(1) G的基态原子的外围电子排布式为_____________________________________,在周期表中属于________区。
(2) B与F形成的一种非极性分子的电子式为_________________________;F的一种具有强还原性的氧化物分子的VSEPR模型为___________。
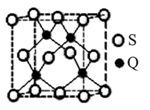
(3) BD2在高温高压下所形成的晶胞如下图所示。该晶体的类型属于______(选填“分子”、“原子”、“离子”或“金属”)晶体。
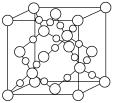
(4) 设C元素的气态氢化物为甲,最高价氧化物的水化物为乙,甲与乙反应的产物为丙。常温下,有以下3种溶液:①pH=11的甲的水溶液 ②pH=3的乙的水溶液
③pH=3的丙溶液,3种溶液中水电离出的c(H+)之比为________________。
(5) 丁、戊分别是E、F两种元素最高价含氧酸的钠盐,丁、戊溶液能发生反应。当丁、戊溶液以物质的量之比为1∶4混合后,溶液中各离子浓度大小顺序为________。
(6) A和C形成的某种氯化物CA2Cl可作杀菌剂,其原理为CA2Cl遇水反应生成一种具有强氧化性的含氧酸,写出CA2Cl与水反应的化学方程式:____________________。
(7) 往G的硫酸盐溶液中加入过量氨水,可生成一种配合物X,下列说法正确的是__。
A.X中所含化学键有离子键、极性键和配位键
B.X中G2+给出孤对电子,NH3提供空轨道
C.组成X的元素中第一电离能最大的是氧元素
D.SO 与PO
与PO 互为等电子体,空间构型均为正四面体
互为等电子体,空间构型均为正四面体
-
(18分)A、B、C、D、E、F是周期表中的前20号元素,原子序数逐渐增大。A元素是宇宙中含量最丰富的元素,其原子的原子核内可能没有中子。B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相等;C元素原子最外层p能级比s能级多1个电子;D原子p轨道上成对电子数等于未成对电子数;E的常见化合价为+3;F最高正价与最低负价的代数和为4;G+的M层电子全充满。用化学式或化学符号回答下列问题:
(1)G的基态原子的外围电子排布式为__________,在周期表中属于________区。
(2)B与F形成的一种非极性分子的电子式为__________;F的一种具有强还原性的氧化物分子的VSEPR模型为__________。
(3)BD2在高温高压下所形成的晶胞如下图所示。该晶体的类型属于______(选填“分子”、“原子”、“离子”或“金属”)晶体。

(4)设C元素的气态氢化物为甲,最高价氧化物的水化物为乙,甲与乙反应的产物为丙。常温下,有以下3种溶液:①pH=11的甲的水溶液 ②pH=3的乙的水溶液 ③pH=3的丙溶液,3种溶液中水电离出的c(H+)之比为____________。
(5)丁、戊分别是E、F两种元素最高价含氧酸的钠盐,丁、戊溶液能发生反应。当丁、戊溶液以物质的量之比为1∶4混合后,溶液中各离子浓度大小顺序为________。
(6)A和C形成的某种氯化物CA2Cl可作杀菌剂,其原理为CA2Cl遇水反应生成一种具有强氧化性的含氧酸,写出CA2Cl与水反应的化学方程式:_______________。
(7)往G的硫酸盐溶液中加入过量氨水,可生成一种配合物X,下列说法正确的是_______。
A.X中所含化学键有离子键、极性键和配位键
B.X中G2+给出孤对电子,NH3提供空轨道
C.组成X的元素中第一电离能最大的是氧元素
D.SO42-与PO43-互为等电子体,空间构型均为正四面体
-
【化学-选修3:物质结构与性质】
A、B、C、D、E是周期表中的前四周期的元素,原子序数逐渐增大。A 元素是宇宙中含量最丰富的元素,其原子的原子核内可能没有中子;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相等;C元素原子p能级比s能级多l个电子;D 基态原子最外层电子排布图为 ;E的M层电子全充满,用化学式或化学符号回答下列问题:
;E的M层电子全充满,用化学式或化学符号回答下列问题:
(1)某权威刊物报道.科学家在宁宙中发现A3分子,甲、乙、丙、丁四位学生对比报道的认识正确的是________(填字号).
A.甲认为上述发现绝对不可能,因为A3分子违背了共价键理论
B.乙认为A3分子实质上是A2分子与A+以特殊共价键结合的产物,应写成A3+
c.丙认为如果上述的发现存在,则证明传统的价键理论有一定的局限性有待继续发展
d .丁认为宁宙中还存在另一种A单质,因为A有三种同位素,必有三种同素异形体
(2)A与B、A与C形成的最简单化合物中沸点较高的是______(填化学式),原因是_________。
(3)B与C形成的最简单非极性分子的电子式是_________;B元素最高价氧化物对应的水化物分子中的酸根离子的VSEPR模型为___________型,键角是___________。
(4)DC3熔点为1040℃,且在1272℃时升华.该晶体的类型属于________晶体,该晶体加热条件下能够和水蒸气反应生成一种能够腐蚀玻璃的气体和一种耐火材料,比反应方程式是____________。
(5)E的氧化物E2O晶体的晶胞结构如右图所示,其中“△”代表的离子符号为___________。
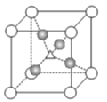
(6)向ESO4溶液中加入过量氨水,可生成一种配合物X,该配合物中,E2+的配位数是__________,形成的配位键中NH3提供_______。
-
A、B、C、D、E、F是周期表中的前20号元素,原子序数逐渐增大。A元素是宇宙中含量最丰富的元素,其原子的原子核内可能没有中子。B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相等;C元素原子最外层p能级比s能级多1个电子;D原子p轨道上成对电子数等于未成对电子数;E的常见化合价为+3;F最高正价与最低负价的代数和为4; G+的M层电子全充满。用化学式或化学符号回答下列问题:

(1)G的基态原子的外围电子排布式为________,周期表中F属于________区。
(2)B与F形成的一种非极性分子的电子式为________;F的一种具有强还原性的氧化物分子的VSEPR模型为________
(3)BD2在高温高压下所形成的晶胞如右图所示。该晶体的类型属于_______________
(选填“分子”、“原子”、“离子”或“金属”)晶体
(4)设C元素的气态氢化物为甲,最高价氧化物的水化物为乙,甲与乙反应的产物为丙。常温下,有以下3种溶液:①pH=11的甲的水溶液 ②pH=3的乙的水溶液 ③pH=3的丙溶液,3种溶液中水电离出的cH+之比为________
(5)丁、戊分别是E、F两种元素最高价含氧酸的钠盐,丁、戊溶液能发生反应。当丁、戊溶液以物质的量之比为1:4混合后,溶液中各离子浓度大小顺序为________
(6)A和C形成的某种氯化物CA2Cl可作杀菌剂,其原理为CA2Cl遇水反应生成一种具有强氧化性的含氧酸,写出CA2Cl与水反应的化学方程式:___________________________________
(7)往G的硫酸盐溶液中加入过量氨水,可生成一种配合物X,下列说法正确的是_____________
A.X中所含化学键有离子键、极性键和配位键
B.X中G2+给出孤对电子,NH3提供空轨道
C.组成X的元素中第一电离能最大的是氧元素
D.SO42-与PO43-互为等电子体,空间构型均为正四面体
-
前四周期元素A、B、C、D、E、F的原子序数依次增大,A是宇宙中含量最丰富的元素;B和C同一主族,且B的L层电子数是K层电子数的2.5倍;D和C同一周期;E元素原子核外电子有17种不同的运动状态,F位于第四周期,其未成对电子数只有一个,且内层都处于全充满状态。请回答下列问题:
(1)B原子的L层轨道表达式________________________;D元素原子的价电子排布式是___________。
(2)由A、B原子形成的分子的结构式为:A-B=B-A,则该分子中σ键和π键的数目之比为________, B、C的氢化物中BH3的沸点高于 CH3的沸点,原因是________________________________________;C、D和E的电负性由大到小的顺序为___________;C、D和E的第一电离能由大到小的顺序是__________________;C和D最高价含氧酸的酸性由弱到强的顺序为_________________。CO43-中C的杂化方式为___________,该粒子的“VSEPR”模型为__________形。
(3)向FDO4溶液中加入过量稀氨水,得到的深蓝色溶液中阳离子化学式为_________,该离子的配位体为________________。

(4)D(黑球)和F(白球)形成的某种晶体的晶胞如右图所示,已知该 晶胞的棱长为516 pm,则该晶胞的密度为___________g/cm3(精确到0.1),最近的黑球和白球之间的距离为
____________pm。
-
前四周期元素A、B、C、D、E、F的原子序数依次增大,A是宇宙中含量最丰富的元素;B和C同一主族,且B的L层电子数是K层电子数的2.5倍;D和C同一周期;E元素原子核外电子有17种不同的运动状态,F位于第四周期,其未成对电子数只有一个,且内层都处于全充满状态。请回答下列问题:
(1)B原子的L层轨道表达式________________________;D元素原子的价电子排布式是___________。
(2)由A、B原子形成的分子的结构式为:A-B=B-A,则该分子中σ键和π键的数目之比为________, B、C的氢化物中BH3的沸点高于 CH3的沸点,原因是________________________________________;C、D和E的电负性由大到小的顺序为___________;C、D和E的第一电离能由大到小的顺序是__________________;C和D最高价含氧酸的酸性由弱到强的顺序为_________________。CO43-中C的杂化方式为___________,该粒子的“VSEPR”模型为__________形。
(3)向FDO4溶液中加入过量稀氨水,得到的深蓝色溶液中阳离子化学式为_________,该离子的配位体为________________。

(4)D(黑球)和F(白球)形成的某种晶体的晶胞如右图所示,已知该 晶胞的棱长为516 pm,则该晶胞的密度为___________g/cm3(精确到0.1),最近的黑球和白球之间的距离为
____________pm。
-
【化学—选修3:物质结构】前四周期原子序数依次增大的六种元素,A、B、C、D、E、H中,A元素在宇宙中含量最丰富,B元素基态原子的核外有3种能量不同的原子轨道,且每种轨道中的电子数目相同。D元素是地壳中含量最多的元素,E为d区元素,其外围电子排布中有4对成对电子,H元素基态原子最外层只有一个电子,其它层均已充满电子。
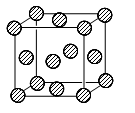
(1)E元素在周期表中的位置是 。
(2)六种元素中电负性最大的元素为 ,前五种元素中第一电离能最小的元素为______(写元素符号)。C元素与元素氟能形成C2F2分子,该分子中C原子的杂化方式是____________。
(3)配合物E(BD)4常温下为液态,易溶于CCl4、苯等有机溶剂,据此判断该分子属于 分子(填“极性”或“非极性”)。该分子中σ键与π键数目比为 。
(4)H单质的晶胞结构如图所示,则原子采取的堆积方式为 ,若已知H原子半径为r pm ,NA表示阿伏伽德罗常数,摩尔质量为M,用相应字母表示:
①该原子的配位数为 。
②该晶体的密度为 g/cm3。
③H原子采取这种堆积方式的空间利用率为 (用含π表达式表示)。
-
(共10分)A、B、C、D、E五种元素均为短周期元素,原子序数逐渐增大。A是宇宙中含量最高的元素,B可形成多种同素异形体,其中一种的硬度自然界中最大。D元素原子的最外层电子数是次外层电子数的3倍。E元素的最高价氧化物的水化物的酸性强于硫酸。
(1)写出元素C在元素周期表的位置 ,单质E的工业制备的离子方程式为________。
(2)B、C、D三种元素的最简单氢化物的稳定性从大到小的顺序是 (填化学式),
B的单质在加热条件下能与C的最高价氧化物对应的水化物的浓溶液反应,写出对应的化学方程式 。
(3)A、B、C、D几种元素之间可以形成多种10电子微粒,写出上述10电子微粒中离子之间反应的一个离子方程式: 。
-
 、
、 、
、 、
、 、
、 为原子序数依次增大的短周期主族元素,其中
为原子序数依次增大的短周期主族元素,其中 为宇宙中含量最为丰富的元素,
为宇宙中含量最为丰富的元素, 元素形成的简单气态氢化物的熔沸点最高,
元素形成的简单气态氢化物的熔沸点最高, 与
与 和
和 能形成化学式为
能形成化学式为 和
和 的离子化合物,Z的最外层电子数是W、X、Y元素最外层电子数之和的一半。Q为Y的最高价氧化物对应水化物。下列有关说法正确的是( )
的离子化合物,Z的最外层电子数是W、X、Y元素最外层电子数之和的一半。Q为Y的最高价氧化物对应水化物。下列有关说法正确的是( )
A. 离子化合物中阴离子的半径比
离子化合物中阴离子的半径比 小
小
B.Z元素的单质和最高价氧化物均能与Q的溶液反应
C. 元素与
元素与 元素能形成两种化合物,且所含化学键类型相同
元素能形成两种化合物,且所含化学键类型相同
D. 的单质与
的单质与 的溶液反应生成
的溶液反应生成 ,转移
,转移 个电子
个电子
-
【化学——选修3:物质结构与性质】已知X、Y、Z、R、Q为周期表中原子序数依次增大的前36号元素。相关信息如下:
| X元素是宇宙中最丰富的元素 |
| Y元素基态原子的核外p电子数比s电子数少1 |
| Z元素被誉为“太空金属”,也有“生物金属”之称,其基态原子次外层有2个未成对电子 |
| R元素在元素周期表的第十一列 |
| Q元素在周期表里与R元素在同一个分区 |
请回答下列问题:
(1)YX3中心原子的杂化轨道类型是 ,离子化合物YX5的电子式是 。
(2)CO与Y2属于等电子体,1 个CO分子中含有的π键数目是 个。
(3)工业上利用ZO2和碳酸钡在熔融状态下制取化合物A(A可看做一种含氧酸盐)。A晶体的晶胞为正方体(如右图)。
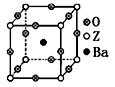
①制备A的化学反应方程式是 ;
②在A晶体中,Z的配位数为 ;
③在A晶体中,若将Z元素置于立方体的体心,Ba元素置于立方体的顶点,则O元素处于立方体的 。
(4)R2+离子的外围电子层电子排布式为 。R2O的熔点比R2S的 (填“高”或“低”)。
(5)Q元素和硫(S)元素能够形成化合物B。B晶体的晶体为正方体(如右图),若晶胞棱长为540.0 pm,则晶胞密度为 g·cm—3(列式并计算)。

与PO
互为等电子体,空间构型均为正四面体







