-
下列电离方程式不正确的是( )
A.NH3•H2O⇌NH4++OH-
B.Ca(OH)2⇌Ca2++2OH-
C.HCO3-⇌H++CO32-
D.Al2(SO4)3═2Al3++3SO42-难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.纯锌与稀硫酸反应时,加入少量CuSO4溶液,可使反应速率加快
B.甲醇和氧气以及KOH溶液构成的新型燃料电池中,其负极上发生的反应为:CH3OH+6OH-+6e-═CO2↑+5H2O
C.在铁上镀铜时,金属铜作阴极
D.电解MgCl2溶液可制得Mg单质难度: 中等查看答案及解析
-
对于可逆反应:2SO2(g)+O2(g)⇌2SO3(g)△H<0,下列研究目的和示意图相符的是( )
A B C D 研究目的 压强对反应的影响
(p2>p1)温度对反应的影响 平衡体系增加O2的浓度对反应的影响 体积恒定的密闭容器中催化剂对反应的影响 图示 


A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
25℃时,水的电离达到平衡:H2O⇌H++OH-;△H>0,下列叙述正确的是( )
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变
C.向水中通入HCl气体,平衡逆向移动,溶液导电能力减弱
D.将水加热,KW增大,pH不变难度: 中等查看答案及解析
-
下列各装置中都盛有0.1mol•L-1的NaCl溶液,放置一定时间后,装置中的四块相同锌片,腐蚀速率由快到慢的顺序是( )

A.③①④②
B.①②④③
C.①②③④
D.②①④③难度: 中等查看答案及解析
-
分析能量变化示意图,下列选项正确的是( )

A.S(s,单斜)+O2(g)=SO2(g)△H=+297.16 kJ•mol-1
B.S(s,单斜)+O2(g)=SO2(g)△H=-296.83 kJ•mol-1
C.S(s,正交)+O2(g)=SO2(g)△H=-296.83 kJ•mol-1
D.单斜硫比正交硫更稳定难度: 中等查看答案及解析
-
固体离子导体依靠离子迁移传导电流,Ag+离子可以在RbAg4I5晶体中迁移.下图是一种固体电池.空气中的O2透过聚四氟乙烯膜与AlI3反应生成I2,Ag和I2作用形成原电池.下列说法中错误的是( )

A.I2在石墨上被还原
B.石墨电极为负极,银电极为正极
C.Ag+从负极向正极移动
D.银电极的电极反应是:Ag-e-=Ag+难度: 中等查看答案及解析
-
已知反应:2SO2(g)+O2(g)⇌2SO3(g)△H<0.某温度下,将2mol SO2和1mol O2置于10L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示.则下列说法正确的是( )

A.由图甲知,A点SO2的平衡浓度为0.4 mol/L
B.由图甲知,B点SO2、O2、SO3的平衡浓度之比为2:1:2
C.达平衡后,缩小容器容积,则反应速率变化图象可以用图乙表示
D.压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则T2>T1难度: 中等查看答案及解析
-
利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍.
反应一:Ni(粗,s)+4CO(g)Ni(CO)4(g)△H<0
反应二:Ni(CO)4(g)Ni(纯,s)+4CO(g)△H>0
下列说法错误的是( )
A.对于反应一,适当增大压强,有利于Ni(CO)4的生成
B.提纯过程中,CO气体可循环使用
C.升高温度,反应一的反应速率减小,反应二的速率增大
D.对反应二,在180-200℃,温度越高,Ni(CO)4(g)的转化率越高难度: 中等查看答案及解析
-
某学习小组为了探究 BrO3-+5Br-+6H+=3Br2+3H2O 反应速率(v)与反应物浓度的关系,在20℃进行实验,所得的数据如下表:
下列结论不正确的是( )
实验编号
相关数据① ② ③ ④ ⑤ c(H+)/mol•L-1 0.008 0.008 0.004 0.008 0.004 c(BrO3-)/mol•L-1 0.001 0.001 0.001 0.002 0.002 c(Br-)/mol•L-1 0.10 0.20 0.20 0.10 0.40 v/mol•L-1•s-1 2.4×10-8 4.8×10-8 1.2×10-8 4.8×10-8 v1
A.若温度升高到40℃,则反应速率增大
B.实验②、④,探究的是c(BrO3-)对反应速率的影响
C.若该反应速率方程为v=k ca(BrO3-)cb(Br-)cc(H+)(k为常数),则c=2
D.实验⑤中,v1=4.8×10-8mol•L-1•s-1难度: 中等查看答案及解析
-
下列生活中的现象,不涉及化学变化的是( )
A.用糯米酿酒
B.用干冰进行人工降雨
C.用过氧乙酸杀菌消毒
D.绿色植物的光合作用难度: 中等查看答案及解析
-
下列实验操作或装置正确的是( )
A.
点燃酒精灯
B.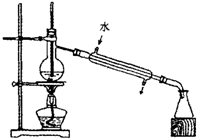
蒸馏
C.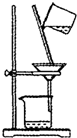
过滤
D.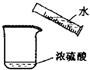
稀释浓硫酸难度: 中等查看答案及解析
-
下列化合物能够由单质直接化合得到的是( )
A.FeCl2
B.NO2
C.SO3
D.Na2O2难度: 中等查看答案及解析
-
下列反应中不属于氧化还原反应的是( )
A.H2+CuOCu+H2O
B.2Na+Cl22NaCl
C.2H2O22H2O+O2↑
D.Na2SO4+BaCl2═2NaCl+BaSO4↓难度: 中等查看答案及解析
-
能用离子方程式H++OH=H2O表示的化学反应是( )
A.氨水和稀盐酸反应
B.Ba(OH)2溶液和稀硫酸反应
C.KOH溶液和稀盐酸反应
D.KOH溶液和CO2反应难度: 中等查看答案及解析
-
如图为原电池示意图,下列说法正确的是( )
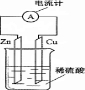
A.锌片是正极,铜片是负极
B.硫酸的浓度不变
C.该装置能够将电能转化为化学能
D.电子由锌片通过导线流向铜片难度: 中等查看答案及解析
-
下列实验装置能达到实验目的是( )
A.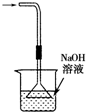
吸收HCl尾气
B.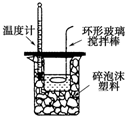
测定中和热
C.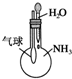
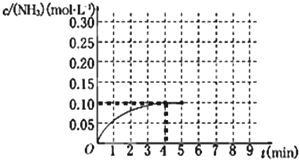
验证NH3易溶于水
D.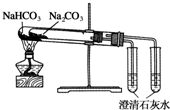
比较Na2CO3与NaHCO3的稳定性难度: 中等查看答案及解析
-
下列图示与对应的叙述相符的是( )

A.图1表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
B.图2表示0.1000mol•L-1NaOH溶液滴定20.00mL0.1000mol•L-1CH3COOH溶液所得到的滴定曲线
C.图3表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液
D.图4 表示某可逆反应生成物的量随反应时间变化的曲线,由图知t时反应物转化率最大难度: 中等查看答案及解析
-
NA代表阿伏加德罗常数.下列有关叙述正确的是( )
A.标准状况下,2.24 L H2O含有的分子数大于0.1NA
B.常温下,100 mL 1 mol/L Na2CO3溶液中阴离子总数小于0.1NA
C.分子数为NA的C2H4气体体积约为22.4 L
D.1.7 g NH3中含N-H键数目为0.1NA难度: 中等查看答案及解析
-
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图.反应中镁和铝的( )

A.物质的量之比为3:2
B.质量之比为3:2
C.摩尔质量之比为2:3
D.反应速率之比为2:3难度: 中等查看答案及解析