-
甲醇是重要的化工原料和燃料,CO、CO2在催化剂的作用下都可以合成甲醇。
Ⅰ. 工业上一般在恒容密闭容器中采用下列反应合成甲醇:
CO(g)+2H2(g) CH3OH(g) ΔH
CH3OH(g) ΔH
(1)判断反应达到平衡状态的依据是___________(填字母)。
A. CH3OH的浓度不再发生变化 B. 生成CH3OH的速率与消耗CO的速率相等
C. 氢气的体积分数保持不变 D. 混合气体的密度不变
(2)为研究平衡时CO的转化率与反应物投料比 及温度的关系,研究小组在10 L的密闭容器中进行模拟反应,并绘出下图。
及温度的关系,研究小组在10 L的密闭容器中进行模拟反应,并绘出下图。
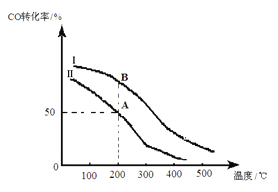
①反应热△H_______0(填“>”或“<”),判断依据是__________________________。
②若其他条件相同,Ⅰ、Ⅱ曲线分别表示投料比不同时的反应过程。
a. 投料比:Ⅰ______Ⅱ(填“>”、“<”或“=”)。
b. 若Ⅱ反应的n(CO)起始=10 mol、 投料比为0.5,A点的平衡常数KA =________,B点的平衡常数KB_______KA (填“>”、“<”或“=”)。
③要提高CO的转化率,可以采取的措施是_______________。(填字母)
a. 升温 b. 加入催化剂
c. 增大压强 d. 加入惰性气体
Ⅱ. 用CO2在催化剂的作用下合成甲醇的反应为:CO2(g)+3H2(g) CH3OH(g)+H2O(g)某密闭容器中充入3 mol氢气和1 mol二氧化碳,测得混合气体中甲醇的体积分数与温度的关系如下图所示。
CH3OH(g)+H2O(g)某密闭容器中充入3 mol氢气和1 mol二氧化碳,测得混合气体中甲醇的体积分数与温度的关系如下图所示。

(1)下图中Q点的速率υ正_______υ逆(填“>”、“<”或“=”)。
(2)解释T0~T1内甲醇的体积分数变化趋势的原因_______________________。
-
工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g)⇌CH3OH(g)
(1)判断反应达到平衡状态的依据是(填字母序号,下同)______.
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的相对平均分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
(2)下表所列数据是反应在不同温度下的化学平衡常数(K).
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
①由表中数据判断该反应的△H______0(填“>”、“=”或“<”);
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则CO的转化率为______,此时的温度为______.
(3)要提高CO的转化率,可以采取的措施是______.
a.升温 b.加入催化剂 c.增加CO的浓度
d.加入H2加压e.加入惰性气体加压 f.分离出甲醇.
-
工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g)⇌CH3OH(g)
(1)判断反应达到平衡状态的依据是(填字母序号,下同)________.
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的相对平均分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
(2)如表所列数据是反应在不同温度下的化学平衡常数(K).
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
①由表中数据判断该反应的△H________0(填“>”、“=”或“<”);
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则CO的转化率为________,此时的温度为________.
(3)要提高CO的转化率,可以采取的措施是________.
a.升温b.加入催化剂c.增加CO的浓度
d.加入H2加压e.加入惰性气体加压f.分离出甲醇
(4)一定条件下,CO与H2在催化剂的作用下生成5molCH3OH的能量变化为454kJ.在该温度时,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1molCO、2molH2 | 1molCH3OH | 2molCH3OH |
| 平衡时数据 | CH3OH的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | akJ | bkJ | ckJ |
| 体系压强(Pa) | p1 | p2 | p3 |
| 反应物转化率 | α1 | α2 | α3 |
下列说法正确的是________.
A.2c1>c3B.a+b<90.8C.2p2<p3D.α1+α3<1.
-
工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g)⇌CH3OH(g)△H
(1)判断反应达到平衡状态的依据是______(填序号).
a. 生成CH3OH的速率与消耗CO的速率相等
b. 混合气体的密度不变
c. 混合气体的总物质的量不变
d. CH3OH、CO、H2的浓度都不再发生变化
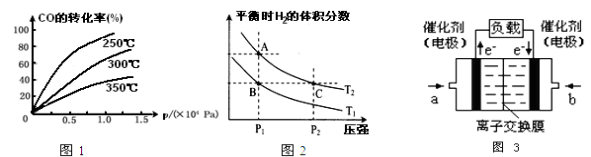
(2)CO在不同温度下的平衡转化率与压强的关系如图1

①该反应△H______0(填“>”或“<”).
②实际生产条件控制在250℃、1.3×104 kPa左右,选择此压强的理由是______.
(3)右图2表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A______C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A______C,由状态B到状态A,可采用______的方法(填“升温”或“降温”).
(4)一定条件下,0.5mol甲醇蒸气完全燃烧生成二氧化碳气体和液态水,放出Q KJ的热量.写出该反应的热化学方程式______.
(5)图3是甲醇燃料电池(电解质溶液为KOH溶液)结构示意图,写出 a处电极上发生的电极反应式______.
-
(14分)工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
(1)判断反应达到平衡状态的依据是(填字母序号)__________
A. 生成CH3OH的速率与消耗CO的速率相等 B. 混合气体的密度不变
C. 混合气体的相对平均分子质量不变 D. CH3OH、CO、H2的浓度都不再发生变化
(2)下表所列数据是反应在不同温度下的化学平衡常数(K)
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
①该反应化学平衡常数表达式K=
②由表中数据判断该反应的△H__________0(填“>”、“=”或“<”);
③某温度下,将2molCO和6mol H2充入2L的密闭容器中,充分反应后,达到平衡时测得C(CO)=0.2mol·L-1,此时的温度为__________
(3)25℃101KPa下,1g液态甲醇完全燃烧生成CO2和液态水时放出热量22.68kJ,表示甲醇燃烧热的热化学方程式为
(4)据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,该电池工作时负极电极反应式为 。若反应时消耗16g甲醇所产生的电能电解足量的CuSO4溶液,则将产生标准状况下的O2________升
-
工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:
CO(g) + 2H2(g)  CH3OH(g)
CH3OH(g)
(1)判断反应达到平衡状态的依据是(填字母序号,下同)__________。
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的相对平均分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
E. 容器中气体的压强不再改变
(2)下表所列数据是反应在不同温度下的化学平衡常数(K)。
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
①由表中数据判断该反应的△H__________0(填“>”、“="”" 或“<”);
②某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO) =" 0.2" mol/L,则CO的转化率为__________,此时的温度为__________。
(3)要提高CO的转化率,可以采取的措施是__________。
a. 升温 b. 加入催化剂
c. 增加CO的浓度 d. 恒容下加入H2使容器内压强变大
e. 分离出甲醇 f. 恒容下加入惰性气体使容器内压强变大
(4)在250℃时,某时刻测得该温度下的密闭容器中各物质的物质的量浓度见下表:
| CO | H2 | CH3OH |
| 0.5 mol·L-1 | 2mol·L-1 | 6mol·L-1 |
此时反应的正、逆反应速率的关系是:v(正)________v(逆)(填“>”、“="”" 或“<”)。
(5)如图1所示,甲为恒容密闭容器,乙为恒压密闭容器。在甲、乙两容器中分别充入等物质的量的H2和CO,使甲、乙两容器初始容积相等。在相同温度下发生上述反应,并维持反应过程中温度不变。在图2中标出甲、乙两容器中CO的转化率随时间变化的对应图像(在图2相应曲线右侧的框格中分别标注“甲”、“乙”)。
-
工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:
CO(g) +2H2(g)  CH3OH(g) ΔH
CH3OH(g) ΔH
(1)判断反应达到平衡状态的依据是________(填序号)。
a. 生成CH3OH的速率与消耗CO的速率相等
b. 混合气体的密度不变
c. 混合气体的总物质的量不变
d. CH3OH、CO、H2的浓度都不再发生变化
(2)CO在不同温度下的平衡转化率与压强的关系如图1。

①该反应△H___0(填“>”或“<”)。
②实际生产条件控制在250℃、1.3ⅹ104 kPa左右,选择此压强的理由是_______。
(3)右图2表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A____C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A_____C,由状态B到状态A,可采用______的方法(填“升温”或“降温”)。

(4)一定条件下,0.5mol甲醇蒸气完全燃烧生成二氧化碳气体和液态水,放出Q KJ的热量。写出该反应的热化学方程式________。
(5)图3是甲醇燃料电池(电解质溶液为KOH溶液)结构示意图,写出 a处电极上发生的电极反应式________。

-
工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g) +2H2(g)  CH3OH(g) ΔH<0
CH3OH(g) ΔH<0
(1)判断反应达到平衡状态的依据是______(填序号)。
a.生成CH3OH的速率与消耗CO的速率相等
b.混合气体的密度不变
c.混合气体的总物质的量不变
d.CH3OH、CO、H2的浓度都不再发生变化
(2)下图表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A______C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A______C,由状态B到状态A,可采用______的方法(填“升温”或“降温”)。


(3)图I是反应时CO和CH3OH的浓度随时间的变化情况,从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)=______。
(4)写出该反应的热化学方程式______________________________。
(5)当温度升高时,该平衡常数K将________(填“增大”、“减小”或“不变”)。
(6)恒容条件下,下列措施中能使 增大的有______.
增大的有______.
A.升高温度 B.充入He气
C.再充入1molCO和2molH2 D.使用催化剂
(7)在恒温条件下,扩大容器体积,则平衡____(填“逆向移动”、“正向移动”、“不移动”)
-
工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g) +2H2(g)  CH3OH(g) ΔH
CH3OH(g) ΔH
(1)判断反应达到平衡状态的依据是______(填序号)。
a.生成CH3OH的速率与消耗CO的速率相等 b.混合气体的密度不变
c.混合气体的总物质的量不变 d.CH3OH、CO、H2的浓度都不再发生变化
(2)CO在不同温度下的平衡转化率与压强的关系如图1。


实际生产条件控制在250℃、1.3ⅹ104 kPa左右,选择此压强的理由是______。
(3)右图2表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A______C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A______C,由状态B到状态A,可采用______的方法(填“升温”或“降温”)。

(4)图I是反应时CO和CH3OH的浓度随时间的变化情况,从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)=______。
(5)写出该反应的热化学方程式______________________________
(6)当温度升高时,该平衡常数K将________(填“增大”、“减小”或“不变”)。
(7)恒容条件下,下列措施中能使 增大的有______
增大的有______
A.升高温度 B.充入He气 C.再充入1molCO和2molH2 D.使用催化剂
(8)在恒温条件下,保持CO浓度不变,扩大容器体积,则平衡______(填“逆向移动”、“正向移动”、“不移动”)
-
工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:
CO(g)+2H2(g) CH3OH(g)ΔH
CH3OH(g)ΔH
(1)能判断反应达到平衡状态的依据是 (填字母序号)。
A.2V 逆(H 2) = V正(CO)
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.CH3OH、CO、H 2的浓度都不再发生变化
E.容器内CO、H 2、CH3OH的浓度之比为1:2:1
F、CO、H2 、CH3OH的速率之比为1:2:1
(2)CO在不同温度下的平衡转化率与压强的关系如图1,该反应△H 0(填“>”或“<”)
(3)一定温度下,将4a mol H 2和2amol CO放入2L的密闭容器中,充分反应后测得CO的转化率为50%,则:
①该反应的平衡常数为 。
②若此时再向该容器中投入a mol CO、2amol H 2 和amol CH3OH,判断平衡移动的方向是 (“正向移动”“逆向移动”或“不移动”);
③在其他条件不变的情况下,将容器体积压缩到原来的 ,与原平衡相比
,与原平衡相比 ,下列有关说法正确的是 (填字母).
,下列有关说法正确的是 (填字母).
A.H2的浓 度减小;
度减小;
B.正反应速率加快,逆反应速率也加快;
C.甲醇的物质的量增加;
D.重新平衡时, 增大;
增大;
(4)上图2表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A C,由状态B到状态A,可采用 的方法(填“升温”或“降温”).
(5)甲醇燃料电池(电解质溶液为KOH溶液)结构示意图3,写出 a处电极上发生的电极反应式

 及温度的关系,研究小组在10 L的密闭容器中进行模拟反应,并绘出下图。
及温度的关系,研究小组在10 L的密闭容器中进行模拟反应,并绘出下图。









