-
下列科学性与其重要贡献对应关系错误的是
A. 屠呦呦 创制新型抗疟疾药青蒿素和双氢青蒿素
B. 阿伏加德罗 提出苯分子是由6个碳原子以单、双键相互交替结合而成的环状结构
C. 拉瓦锡 创立氧化说以解释燃烧等试验现象,推翻了燃素说,验证了质量守恒定律
D. 门捷列夫 发现化学元素的周期性并依照相对原子质量制作出世界上第一张元素周期表
难度: 中等查看答案及解析
-
下列说法正确的是
A. 聚乙烯、淀粉和蛋白质都是天然高分子化和物
B. 乙酸可发生酯化反应,不能发生取代反应
C. 甲苯彻底催化加氢后,所得产物的一氯取代物共有5种
D. 乙苯分子中的碳原子不可能都处于同—平面
难度: 中等查看答案及解析
-
下列实验方案中,不能达到试验目的的是
选项
实验目的
实验方案
A
检验Na2S2O3晶体中是否含有Na2SO3
将少量样品溶于水,再加入稀H2SO4,然后滴加高锰酸钾溶液,观察紫红色是否褪去
B
证明碳酸钠水解是吸热反应
在碳酸钠溶液中滴入酚酞试液,加热后红色加深
C
验证Br2的氧化性强于I2
将少量溴水加入KI溶液中,再加入CCl4,振荡,静置,观察下层液体是否呈紫色
D
分离铁屑和铜屑
用磁铁吸引
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X是空气的主要组成元素, X与Y同族。下列说法正确的是
A. 原子半径:W<X<Y<Z
B. 气态氢化物的热稳定性:Z<Y
C. W与X 组成的化合物都易溶于水
D. 最离价氧化的水化物的酸性:Z>Y
难度: 困难查看答案及解析
-
已知:
①CO(g) +H2O(g)=CO2(g)+H2(g) △H = -41.2 kJ • mol-1
②CH4(g) +H2O(g)=CO(g) +3H2(g)的能量变化如下图所示
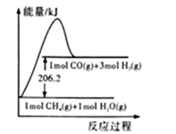
下列有关说法正确的是
A. ①和②均为放热反应
B. ①的反应物总能量低于生成物总能量
C. CO2(g) +CH4(g)=2CO(g) +2H2(g) △W = -247.4 kJ • mol-1
D. CH4(g) +H2O(g)=CO(g) +3H2(g)的活化能大于206.2 kJ • mol-1
难度: 困难查看答案及解析
-
下图所示装置Ⅰ是—种可充电电池,离子交换膜只允许Na+通过,电池充放电的化学方程式为
2Na2S2+ NaBr3
3NaBr+Na2S4;装置Ⅱ为电解池,闭合开关K时,b极附近先变红色。下列说
法正确的是
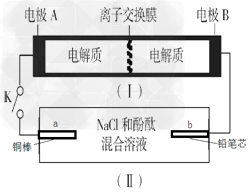
A. 放电时,电极A的反应式为:2S22--2e-=S42-
B. 放电时,正极的反应式为:Br3- +2e-=3Br-
C. 装置Ⅰ放电时,Na+的移动方向为电极A→电极B
D. 装置Ⅱ若将a、b的铜棒、铅笔芯互换,反应现象仍然相同
难度: 困难查看答案及解析
-
下列电解质溶液中的关系正确的是
A. NH4Cl溶液中:c2(H+)w
B. Ca(OH)2溶液中:c(Ca2+)·c2(OH-)≥Ksp[Ca(OH)2]
C. CH3COONa溶液中:c(OH-)=c(H+)+c(CH3COOH)
D. 由 NaAlO2和 NaOH 组成的混合溶液中:c(Na+)>c(AlO2-)+c(OH- )
难度: 困难查看答案及解析
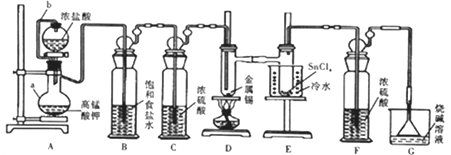
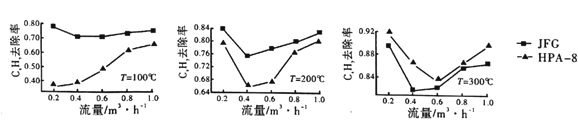

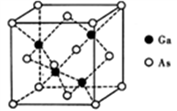
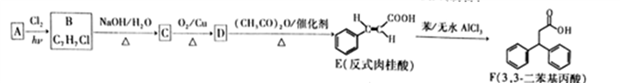
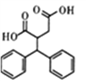 的合成路
的合成路