-
化学在生产和日常生活中有着重要应用。下列说法不正确的是( )
A. 施肥时,草木灰(有效成份K2CO3)不能与NH4Cl混合使用
B. 热的纯碱能去厨房油污是因为其水解呈碱性,可以使油脂水解成水溶性物质
C. 在服用胃舒平(主要成分有氢氧化铝)期间可以食用醋、可乐等食品
D. 使用含氟牙膏预防龋齿利用了沉淀转化的原理
难度: 中等查看答案及解析
-
下列能发生加成反应的有机物是( )
A. 丙烷 B. 甲醛 C. 乙酸 D. 乙醇
难度: 简单查看答案及解析
-
NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 25℃时,1LpH=l的HCl溶液中,由水电离的H+的个数为0.1NA
B. 25℃时,0.1mol/LNaHCO3溶液中含有HCO3-数小于0.1NA
C. 标准状况下,NA个H2O分子所占有的体积约为22.4L
D. lmol(NH4)2Fe(SO4)2·6H2O固体中含有离子总数为5NA
难度: 中等查看答案及解析
-
己知某有机物C6H12O2酸性条件下能发生水解反应生成A和B, B能氧化成C。若A、C都能发生银镜反应,则C6H12O2符合条件的结构简式有(不考虑立体异构)( )
A. 3种 B. 4种 C. 5种 D. 6种
难度: 中等查看答案及解析
-
25℃时,下列各组离子在指定溶液中可能大量共存的是( )
A. pH=l的溶液中:Na+、K+、MnO4-、I-
B. 无色溶液中:Al3+、NH4+、Cl一、S2-
C. 由水电离出的c(H+)=1×10-3mol·L-1的溶液中:Mg2+、Cu2+、SO42-、NO3-
D. 0.lmol·L-1FeC13溶液中:Fe2+、NH4+、SCN-、SO42-
难度: 中等查看答案及解析
-
下列选用的仪器和药品能达到实验目的的是( )
A
B
C
D

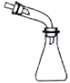


可用于吸收NH3或HCl,并防止倒吸
蒸馏时的接收装置
除去SO2中的少量HCl
准确量取一定体积K2Cr2O7标准溶液
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
100℃时,Kw=1×10-12.下列三种溶液:①0.01mol/LNH4Cl溶液 ②HCl与NaOH溶液等体积混合,所得pH=6的溶液 ③pH= 6.5的NaHCO3溶液。其中呈酸性的是( )
A. ① B. ③ C. ②③ D. ①③
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 电解精炼铜时,阳极泥中含有Zn、Fe、Ag、Au等金属
B. 根据Ksp(CaCO3)<Ksp(CaSO4),在生产中可用Na2CO3溶液处理锅炉水垢中的CaSO4, 使之转化为疏松、易溶于酸的CaCO3
C. 常温下,将醋酸稀溶液加水稀释,溶液中c(H+)/c(CH3COOH)均减小
D. 3H2(g)+WO3 (s)=W(s)+3H2O(g)只有在高温时才能自发进行,则它的△S < 0
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 为比较氯和硫元素非金属性强弱,可测同条件下同浓度的NaCl溶液和Na2S溶液的pH
B. 用盐酸滴定氨水可选用甲基橙作指示剂
C. 在某溶液中滴加盐酸酸化的BaCl2溶液,有白色沉淀生成,则原溶液中一定含SO42 –
D. SO2和Cl2都能使品红溶液褪色,其原理相同
难度: 中等查看答案及解析
-
现有短周期主族元素X、Y、Z、R、T。R原子最外层电子数是电子层数的2倍:Y与Z能形成Z2Y、Z2Y2 型离子化合物,Z与T形成的Z2T化合物能破坏水的电离平衡。六种元素的原子半径与原子序数的关系如图所示。下列推断不正确的是( )
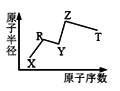
A. Y、Z组成的化合物只含离子键
B. 氢化物的沸点和稳定性排序:R
C. 最高价氧化物对应的水化物的酸性:T> R
D. 由X、Y、Z、T四种元素组成的化合物水溶液一定显酸性
难度: 中等查看答案及解析
-
关于如图所示装置的说法正确的是( )
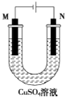
A. 溶液中的Cu2+移向N 极 B. 该装置将电能转变为化学能
C. 若装置用于铁棒镀铜,则M极为铜棒 D. N极发生还原反应
难度: 简单查看答案及解析
-
As2S3和HNO3有如下反应:As2S3+10HNO3 = 2H3AsO4 + 3S+ 10NO2↑+ 2H2O,下列说法正确的是( )
A. 该反应的氧化产物仅为S
B. 生成lmolH3AsO4时转移电子个数为10NA
C. 将反应设计成一原电池,则NO2应该在正极附近逸出
D. 反应产生的NO2与56LO2 (标况)混合在水中正好完全反应生成硝酸
难度: 中等查看答案及解析
-
在某固定体积的绝热密闭容器中进行的可逆反应A (g)+B(g)
C(s)+2D(g),可以说明己达到平衡状态的是( )
①反应容器中压强不随时间变化而变化;②A气体和B气体的生成速率相等;③混合气体的平均摩尔质量不随时间变化而变化;④混合气体的密度不随时间变化而变化⑤化学平衡常数不变
A. ①④⑤ B. ③④ C. ①③④⑤ D. ②③
难度: 中等查看答案及解析
-
下列化学实验事实及解释都正确的是( )
A. 用含有少量硫酸铜的稀硫酸跟锌粒反应,能加快产生氢气,说明Cu2+具有催化能力
B. 升高温度会加快化学反应速率,是因为增加了反应物单位体积内活化分子的百分数
C. 等体积、pH都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说明酸性:HA>HB
D. 向MgC12、CuC12混合溶液中逐滴加入少量氨水,先生成Mg (OH)2沉淀,说明Ksp[Cu(OH)2]>Ksp[Mg(OH)2]
难度: 中等查看答案及解析
-
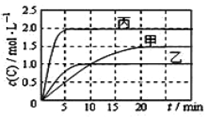
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g)
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下图和下表表示。
容器
甲
乙
丙
容积
1L
1L
2L
温度/℃
T1
T2
T2
反应物
起始量
1molA
2molB
1molA
2molB
4molA
8molB
下列说法正确的是( )
A. 由图可知Tl<T2,且正反应为吸热反应
B. 前5min内甲、乙、丙三个容器中反应的平均速率:v (A)乙<v(A)甲<v(A)丙
C. 平衡时A的转化率a : a乙<a甲<a丙
D. T2时该反应的平衡常数K=1.33
难度: 困难查看答案及解析
-
己知常温下CH3COOH的电离常数为K,该温度下向20mL0.1mol/LCH3COOH溶液中逐滴加入0.1mol/LNaOH溶液,其pH变化曲线如图所示。下列说法不正确的是( )
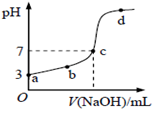
A. c点表示CH3COOH和NaOH恰好完全反应
B. b点表示的溶液中c (CH3COO-)>c(Na+)
C. a点表示的溶液中c (CH3COO-)略小于10-3mo1/L
D. b、d点表示的溶液中
均等于K
难度: 中等查看答案及解析
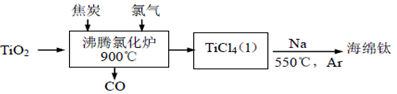
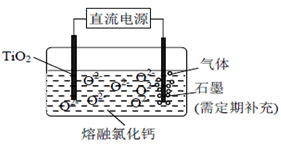
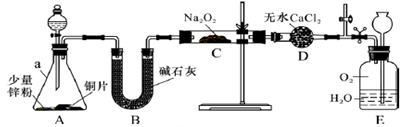
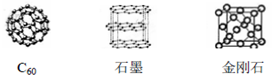
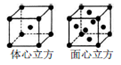

 (R或R´可以是烃基或H原子)。
(R或R´可以是烃基或H原子)。 )的说法正确的是(____)
)的说法正确的是(____)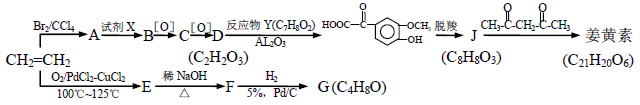
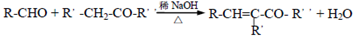 (R、R´、R"表示烃基或氢原子)
(R、R´、R"表示烃基或氢原子)