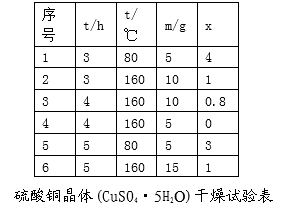
-
下列物质中,属于非电解质的是
A.Na2CO3 B. 硫酸 C. 乙酸 D.SO3
难度: 简单查看答案及解析
-
对于溶液中的反应,下列方法中不能显著改变化学反应速率的是
A.升高温度 B.使用合适的催化剂
C.增大压强 D.增加其中一种反应物的浓度
难度: 简单查看答案及解析
-
化学与生活密切相关,下列应用中利用了物质氧化性的是
A.明矾净化水 B.纯碱去油污 C.食醋除水垢 D.漂白粉漂白织物
难度: 简单查看答案及解析
-
下列说法正确的是
A. 凡是放热反应的发生均无需加热
B.凡是需要加热后才能发生的反应是吸热反应
C. 物质发生化学反应都伴随着能量变化
D.伴有能量变化的物质变化都是化学变化
难度: 简单查看答案及解析
-
下列操作中,能使电离平衡H2O
H++OH-向右移动且溶液呈酸性的是
A. 向水中加入NaHSO4溶液 B. 向水中加入Al2(SO4)3固体
C. 向水中加入Na2CO3溶液 D. 将水加热到100℃时pH=6
难度: 简单查看答案及解析
-
一定条件下,在某密闭容器中,有下列可逆反应:2X(g)+Y(g) 2Z(g);△H<0,下列有关该反应的说法中正确的是
A.该反应的正反应为吸热反应
B.当各物质浓度不再变化时,反应达到平衡状态
C.若温度不变,平衡后把容器的体积增大一倍,平衡将不移动
D.若升高温度,平衡向正反应的方向移动
难度: 中等查看答案及解析
-
能在水溶液中大量共存的一组离子是
A.H+、I-、NO
、SiO32- B.NH4+、OH-、Cl-、HCO3-
C.K+、SO42-、Cu2+、NO3- D.Al3+、Mg2+、SO
、CO32-
难度: 简单查看答案及解析
-
压强对合成氨反应具有重要的影响。下表是反应达到平衡时压强与NH3含量的一些实验数据:
压强/MPa
10
20
30
60
100
NH3含量(体积分数)/%
81.5
86.4
89.9
95.4
98.8
从表中数据可以推断:随着压强增大,平衡时NH3含量
A.增加 B.减少 C.先增加,后减 D.先减少,后增加
难度: 简单查看答案及解析
-
设v(正)和v(逆)分别表示可逆反应的正反应速率和逆反应速率。在一定温度下逆反应: N2+3H2
2NH3达到平衡时
A.v(逆)>v(正) B.v(逆)<v(正)
C.V(逆=V(正),正逆反应停止 D.v(逆)=v(正),正逆反应仍进行
难度: 简单查看答案及解析
-
已知下列热化学方程式:
Zn(s)+1/2O2(g)= ZnO(s) ΔH1 =a kJ/mol;
Hg(l)+1/2O2(g)= HgO(s) ΔH2 =b kJ/mol。
则反应:Zn(s)+HgO(s)= ZnO(s)+Hg(l) △H3 中,△H3的值为
A.(b-a) B.(a-b) C.(a-b)/2 D. (b-a)/2
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A.O2和O3的混合物共16g,其中所含氧原子数为NA
B.1.0L 0.1mol/L的AlCl3溶液中含有的铝离子数为0.1NA
C.1mol金属钠完全转化为Na2O2所转移的电子数目为2NA
D.将2mol SO2和1mol O2在密闭容器中加热(V2O5催化)充分反应,容器内分子总数为2NA
难度: 中等查看答案及解析
-
在容积不变的密闭容器中进行如下反应:N2+3H2
2NH3,若将平衡体系中各物质的浓度都增加到原来的2倍,则产生的结果是
A.平衡不发生移动 B.平衡沿着逆反应方向移动
C.正逆反应速率都增大 D.NH3的质量分数减小
难度: 简单查看答案及解析
-
下图各容器中盛有海水,铁在其中腐蚀时由快到慢的顺序是

A.(4)>(2)>(1)>(3)
B.(2)>(1)>(3)>(4)
C.(4)>(2)>(3)>(1)
D.(3)>(2)>(4)>(1)
难度: 简单查看答案及解析
-
某氢氧燃料电池的电解液是热的KOH溶液,在正极上氧气被还原,在负极上氢气被氧化,下列有关该电池的叙述正确的是
A.负极反应式为:
B.正极反应式为:
C.工作一段时间后,
溶液的浓度不变
D.电池工作时,电子由正极通过外电路流向负极
难度: 中等查看答案及解析
-
如图曲线a表示放热反应X(g)+Y(g)
Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是
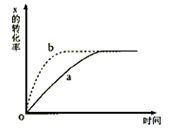
A.升高温度
B.加大X的投入量
C.加催化剂
D.增大体积
难度: 简单查看答案及解析
-
对室温下体积相同,浓度均为0.1 mol·L-1的盐酸和醋酸两种溶液分别采取下列措施。有关叙述一定正确的是
A.加水稀释100倍后,两溶液的pH相同
B.加入NaOH固体恰好中和后,两溶液的pH相同
C.分别加入足量锌粉充分反应,反应开始时两酸产生H2的反应速率相等
D.加人足量的小苏打固体充分反应后,两溶液中产生的CO2一样
难度: 中等查看答案及解析
-
某小组为研究电化学原理,设计如图装置,下列叙述正确的是
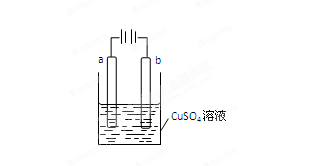
A.若a和b为石墨,通电后a电极上的反应为:Cu2++2e-=Cu
B.若a和b为石墨,通电后滴入酚酞,a电极附近溶液呈红色
C.若a为铜,
b为铁,通电后Cu2+ 向a电极移动
D.若a为粗铜,b为纯铜,通电后b电极质量增加
难度: 中等查看答案及解析
-
下述实验不能达到预期目的的是
编号
实验内容
实验目的
A
将SO2通入酸性KMnO4溶液中
证明SO2具有还原性
B
将Cl2通入NaBr溶液中
比较氯与溴的氧化性强弱
C
将铜与浓硝酸反应生成的气体收集后用冰水混合物冷却降温
研究温度对化学平衡的影响
D
分别向2支试管中加入相同体积不同浓度的H2O2溶液,再向其中1支加入少量MnO2
研究催化剂对H2O2分解速率的影响
难度: 中等查看答案及解析
-
下列实验对应的结论不正确的是
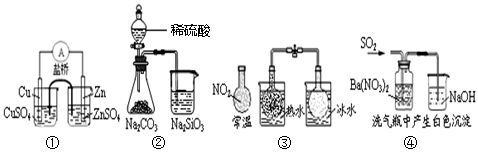
A.①能组成
Zn、Cu原电池 B.② 能证明非金属性:S>C>Si
C.③说明反应2NO2
N2O4 △H<0 D.④ 白色沉淀为BaSO3
难度: 中等查看答案及解析