-
下列说法正确的是
①离子化合物一定含离子键,也可能含极性键或非极性键
②共价化合物一定含共价键,也可能含离子键
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤由分子组成的物质中一定存在共价键
⑥熔融状态能导电的化合物一定是离子化合物
A.①③⑤ B.②④⑥ C.②③④ D.①③⑥
难度: 简单查看答案及解析
-
下列说法不正确的是
A、焓变是一个反应能否自发进行相关的因素,多数放热反应能自发进行
B、在同一条件下不同物质有不同的熵值,其体系的混乱程度越大,熵值越大
C、自发进行的反应一定能迅速进行
D、一个反应能否自发进行,与焓变和熵变的共同影响有关
难度: 中等查看答案及解析
-
中和热测定实验中,下列操作一定会降低实验准确性的是
A 用滴定管(精量仪器,读数保留到0.01)取所用酸碱溶液的体积
B NaOH溶液在倒入小烧杯时,有少量溅出
C、大、小烧杯体积相差较大,夹层间放的碎泡沫塑料较多
D、测量HCl溶液的温度计用水洗净后才用来测NaOH溶液的温度
难度: 中等查看答案及解析
-
下列说法中,正确的是
A、热化学方程式中的化学计量数表示物质的量,可以是分数
B、△H > 0 kJ·mol-1表示放热反应,△H < 0 kJ·mol-1表示吸热反应
C、1 mol H2SO4与1 molBa(OH)2反应生成H2O时放出的热叫做中和热
D、1 mol H2与0.5 molO2反应放出的热就是H2的燃烧热
难度: 中等查看答案及解析
-
运用元素周期律分析下面的推断,其中错误的是
A、砹(At)为有色固体,HAt不稳定
B、铊(T1)是铝的同族元素,原子核外有6个电子层,推测T1(OH)3是两性氢氧化物
C、已知锶Sr与镁同族且原子半径大于钙,硫酸锶(SrSO4)是难溶于水的白色固体
D、硒化氢(H2Se)比硫化氢稳定性差
难度: 中等查看答案及解析
-
近年来,科学家正在探索利用铝粉作为新能源的可能性,以期铝能成为一种石油的取代物。假如铝作为一种普遍使用的新型能源被开发利用,关于其有利因素的下列说法,你认为哪项是错误的
A.铝质轻,便于运输、贮存,且安全
B.在地球上,铝矿资源比较丰富
C.铝燃烧时放出的热量大,且燃烧后新产物对环境的污染容易得到有效的控制
D.现代电解铝的工业技术已为铝作为新能源奠定了重要基础
难度: 中等查看答案及解析
-
下列有关化学用语正确的是
A H2S的结构式:H—S—H B Mg2+的结构示意图:
C 二氧化碳的电子式:
D 考古时利用 68C 来测定一些文物的年代
难度: 中等查看答案及解析
-
短周期金属元素甲~戊在元素周期表中的相对位置如表所示。下列判断正确的是
A 原子半径: 丙<丁<戊 B 氢氧化物碱性:丙>丁>戊
C 金属性:甲>丙 D 最外层电子数:甲>乙
难度: 中等查看答案及解析
-
向一体积为2L的恒容密闭容器里充入1 mol N2和4 molH2,在一定温度下发生反应:
N2(g)+3H2(g)
2NH3(g);△H<0。10秒后达到平衡,c(NH3)为0.4mol/L。下列说法正确的是
A.该反应达平衡时H2的转化率为40% B.降低温度能使混合气体的密度增大
C.向该容器中充入N2,平衡正向移动 D.研发高效催化剂可大大提高N2的转化率
难度: 中等查看答案及解析
-
下列说法中不正确的是
①质子数相同的粒子一定属于同种元素
②同位素的性质几乎完全相同
③质子数相同,电子数也相同的粒子不可能是一种分子和一种离子
④电子数相同的粒子不一定是同一种元素
⑤一种元素只能有一种质量数
⑥互称同位素的两种核素间具有相同的中子数和核外电子数
A.①②④⑤ B.③④⑤⑥ C.②③⑤⑥ D.①②⑤⑥
难度: 中等查看答案及解析
-
X、Y、Z、W四种主族元素,若X的阳离子与Y的阴离子具有相同的电子层结构;W的阳离子的氧化性强于等电荷数的X 阳离子的氧化性;Z阴离子半径大于等电荷数的Y的阴离子半径,则四种元素的原子序数由大到小的顺序是( )
A、Z X Y W B、W X Y Z C、X Y Z W D、Z Y X W
难度: 中等查看答案及解析
-
在一定温度下,反应H2(g)+X2(g)
HX(g)的平衡常数为10。则反应2HX(g)
H2(g)+X2(g)的平衡常数为( )
A 0.01 B 1 C 10 D 100
难度: 中等查看答案及解析
-
不同的金属应选用不同的冶炼方法如:热还原法、热分解法、电解法。你认为选择的原则主要是依据
A.金属在自然界的存在形式 B.金属熔点的高低
C.金属离子得电子的能力 D.金属元素在地壳中的含量
难度: 中等查看答案及解析
-
把A、B、C、D四块金属泡在稀H2SO4中,用导线两两相连可以组成各种原电池。若A、B相连A为负极;C、D相连D上有气泡逸出;A、C相连A 上发生氧化反应;B、D相连,B是电子流入的一极。则四种金属的活泼性顺序由大到小排列为
A A>B>C>D B A>C>B>D C A>C>D>B D B>D>C>A
难度: 中等查看答案及解析
-
已知MgO、MgCl2的熔点分别为2800℃、604℃,将MgO、MgCl2加热熔融后通电电解,都可得到金属镁。海水中含有MgCl2,工业上从海水中提取镁,正确的方法是
A. 海水
Mg(OH)2
Mg
B. 海水
MgCl2溶液
MgCl2熔融
Mg
C. 海水
Mg(OH)2
MgO
Mg
D.海水
Mg(OH)2
MgCl2溶液
MgCl2熔融
Mg
难度: 中等查看答案及解析
-
H2(气)+I2(气)
2HI(气);ΔH<0可逆反应已达化学平衡,下列图象中正确的是
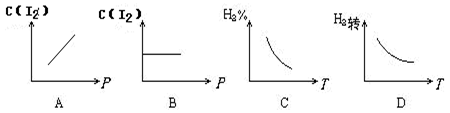
难度: 中等查看答案及解析
-
物质X、Y、Z、W有如下图所示的转化关系,且△H=△H1+△H2,则X、Y可能是
①C和CO ②P和PCl3 ③AlCl
和Al(OH)3 ④NaOH和Na2CO3 ⑤Fe和FeCl
中的

A.①②③ B.②③④ C.③④⑤ D.①②③④
难度: 中等查看答案及解析
-
一定温度下,将2molA、2molB、2molC的气体混合物充入一体积不变的密闭容器中,充分反应后恢复到起始温度,测得容器内的压强比起始时增大30%,则可能发生的反应是
A.2A+B
2C B. A+B
C C.A+B
2C D.A+B
3C
难度: 中等查看答案及解析
-
由铝,铁,铜,银和稀硫酸,可以组成原电池的总数为
A.3种 B.4种 C.5种 D.6种
难度: 中等查看答案及解析
-
下列说法中,能说明化学平衡一定向正反应方向移动的是
A.N2O4(g)
2NO2(g),改变某一条件后,气体颜色加深
B.N2(g) + 3H2(g)
2NH3(g),改变某一条件后,NH3的体积分数增加
C.H2(g) + I2(g)
2HI(g),单位时间内消耗H2和HI的物质的量之比大于1∶2
D.2SO2(g) + O2(g)
2SO3(g),恒温恒容充入He
难度: 中等查看答案及解析
-
下列不能说明氯的非金属性比硫强的事实是
①HCl比H2S稳定 ②HCl和H2S的水溶液前者的的酸性强
③HClO4酸性比H2SO4强 ④Cl2能与H2S反应生成S
⑤Cl原子能得1个电子变成稳定离子而S原子能得两个电子
⑥Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS
A.②⑤ B.①② C.①②④ D.①③⑤
难度: 中等查看答案及解析
-
一定温度下将1 mol SO3 放入2L的反应器内,当反应:2SO3(g)
2SO2(g)+O2(g) 平衡时,容器内有0.6 molSO2,其平衡常数约是
A.0.68 B. 0.34 C.0.45 D.0.47
难度: 中等查看答案及解析
-
在密闭容中发生下列反应aA(g)
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
A.A的转化率变小 B.平衡向正反应方向移动
C.D的体积分数变大 D.a < c+d
难度: 中等查看答案及解析
-
汽车的启动电源常用铅蓄电池,该电池在放电时的反应如下:PbO2 (s)+Pb(s)+2H2SO4(aq)===2PbSO4(s)+2H2O(l),根据此反应判断下列叙述中正确的是
A. PbO2是电池的负极
B. 负极的电极反应式为:Pb(s)+SO42-(aq)–2e – = PbSO4(s)
C. 铅蓄电池属于一次性电池
D. 电池放电时,溶液酸性增强
难度: 中等查看答案及解析
-
下列事实不能用勒沙特列原理解释的是
A.合成氨反应: N2(g)+3H2(g)
2NH3(g) ;△H<0 ,为使氨的产率提高,理论上应采取低温高压的措施
B.对2HI(g)
H2(g)+I2(g)平衡体系增加压强使颜色变深
C.使用催化剂有利于提高SO2与O2生成SO3的效率
D.用排饱和氯化钠溶液的方法来收集氯气
难度: 中等查看答案及解析
-
下列关于化学平衡常数的说法中错误的是
A.化学平衡常数K只与温度有关,随温度的升高,K可能增大、减小或不变
B.催化剂不能改变平衡常数的大小
C.若某一条件的改变,使平衡常数发生了变化,则化学平衡必发生移动
D.化学平衡移动时,平衡常数必改变
难度: 中等查看答案及解析
-
用下列物质冶炼金属的过程中,需要加入还原剂的是
A.Fe2O3 B.Al2O3 C.HgO D.Cu2S
难度: 中等查看答案及解析
-
在体积为VL的恒容密闭容器中盛有一定量H2,通入Br2(g)发生反应:H2(g)+Br2(g)
2HBr(g);ΔH<0。当温度分别为T1、T2平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示。下列说法正确的是
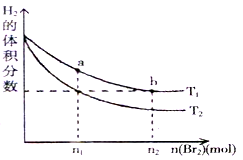
A.由图可知:T2>T1
B.两点的反应速率:a>b
C.T1时,随着Br2(g)加入,平衡时HBr的体积分数不断增加
D.a点比b点体系的颜色深
难度: 中等查看答案及解析
-
在元素周期表主族元素中。甲元素与乙、丙、丁三元素紧密相邻。甲、乙的原子序数之和等于丙的原子序数。这四种元素原子的最外层电子数之和为20。下列判断正确的是
A.原子半径:丙>乙>甲>丁
B.丁或甲与乙所形成的化合物都是有毒的物质
C.最高价氧化物的对应水化物的酸性:丁>甲
D.气态氢化物的稳定性:甲>丙
难度: 中等查看答案及解析
-
某化学反应2A
B+D在四种不同条件下进行。B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
实验序号
温度
0min
10min
20min
30min
40min
50min
60min
1
800℃
1.0
0.80
0.67
0.57
0.50
0.50
0.50
2
800℃
c2
0.60
0.50
0.50
0.50
0.50
0.50
3
800℃
c3
0.92
0.75
0.63
0.60
0.60
0.60
4
820℃
1.0
0.20
0.20
0.20
0.20
0.20
0.20
依上述数据,下列选项错误的是:
A 在实验1中,反应在10至20 min时间内平均速率为0.013mol·(L·min)-1。
B 在实验2中,A的初始浓度c2=1.0 mol/L,反应经20 min就达到平衡,推测实验2中还可能隐含的条件是:使用了合适的催化剂。
C 设实验3的反应速率为v3,实验1的反应速率为v1,则v3>v1,且c3>1.0 mol/L
D 比较实验4和实验1,可推测该反应是放热反应
难度: 中等查看答案及解析