-
废电池的污染引起人们的广泛重视,废电池中对环境形成污染的主要物质或元素是
A.石墨B.二氧化锰 C.锌 D.汞
难度: 简单查看答案及解析
-
下列溶液蒸干后,无法得到原溶质的是
A. CuSO4B. Na2CO3C. FeCl3 D. NaOH
难度: 简单查看答案及解析
-
下列说法正确的是
A.增大压强,活化分子百分数增大,反应速率一定增大
B.升高温度,反应物分子总数增加,活化分子百分数不变,反应速率一定增大
C.加入反应物,使活化分子百分数增大,反应速率增大
D.使用催化剂可降低反应的活化能,增大活化分子百分数,增大反应速率
难度: 简单查看答案及解析
-
下列叙述错误的是
A.从FeCl3固体出发配制其溶液时,应先将FeCl3固体溶解在一定浓度的盐酸溶液中,然后再稀释到所需要的浓度
B.Al3+的水解方程式为 Al3+ + 3H2O
Al(OH)3 + 3H+
C.NaHSO4在水溶液中的电离方程式为 NaHSO4 = Na+ + H+ + SO42-
D.H2CO3的电离方程式为 H2CO3 = H+ + HCO3-
难度: 简单查看答案及解析
-
250℃和1.01105Pa时,反应:2N2O5(g)=4NO2(g)+O2(g) △H=+56.76kJ/mol,自发进行的原因是
A.是吸热反应 B.是放热反应
C.是熵减少的反应 D.熵效应大于焓效应
难度: 简单查看答案及解析
-
恒温、恒压下,反应N2 (g)+3H2 (g)
2NH3 (g)从两条途径分别建立平衡:
Ⅰ.N2、H2的起始浓度分别为1 mol / L和3 mol / L;
Ⅱ.NH3的起始浓度为4 mol / L。下列有关叙述不正确的是:
A.途径Ⅰ与途径Ⅱ所得混合气体的百分组成相同
B.途径Ⅰ的平衡速率v (N2)与途径Ⅱ的平衡速率v (NH3)的比值为1∶2
C.途径Ⅰ所得NH3的浓度与途径Ⅱ所得NH3的浓度之比为1∶2
D.途径Ⅰ与途径Ⅱ所得平衡混合气体的物质的量之比为1∶2
难度: 简单查看答案及解析
-
下列离子能大量共存于同一溶液中的是
A. Na+、HCO3-、Cl-、NO3- B. K+、Fe3+、SCN-、SO42-
C. K+、H+、ClO-、Cl- D. K+、Na+、S2-、Al3+
难度: 简单查看答案及解析
-
下列关于反应能量的说法正确的是
A.相同条件下,如果1 mol氢原子所具有的能量为E1,1 mol 氢分子所具有的能量为E2,则2E1=E2
B. Zn(s)+CuSO4(aq)===ZnSO4(aq)+Cu(s) ΔH=-216 kJmol-1,则反应物总能量>生成物总能量
C.101 kPa时,2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJmol-1,则H2的燃烧热为571.6 kJmol-1
D.H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJmol-1,则1 mol NaOH的氢氧化钠固体与含0.5 mol H2SO4的稀硫酸混合后放出57.3 kJ的热量
难度: 简单查看答案及解析
-
下列各组热化学方程式中,化学反应的ΔH 前者大于后者的是
①C(s)+O2(g)===CO2(g) ΔH1 C(s)+ O2(g)===CO(g) ΔH2
②S(s)+O2(g)===SO2(g) ΔH3 S(g)+O2(g)===SO2(g) ΔH4
③H2(g)+ O2(g)=== H2O(l) ΔH5 2H2(g)+O2(g)===2H2O(l) ΔH6
④CaCO3(s)===CaO(s)+CO2(g) ΔH7 CaO(s)+H2O(l)===Ca(OH)2(s) ΔH8
A.① B.④C.②③④ D.①②③
难度: 简单查看答案及解析
-
下列关于稀HAc溶液叙述正确的是
A.加热后,HAc的电离程度减小
B.加水稀释后,溶液的酸性增强
C.加入NaAc固体后,HAc的电离程度减小
D.加入少量并醋酸后,溶液的酸性减弱
难度: 简单查看答案及解析
-
下列事实能用勒夏特列原理来解释的是
A.由H2、I2、HI组成的平衡体系加压后颜色变深
B.黄绿色的氯水光照后颜色变浅
C.使用催化剂可加快SO2转化为SO3的速率
D.将木炭粉碎后与O2反应,速率更快
难度: 简单查看答案及解析
-
温度相同,浓度均为0.2 molL-1的①(NH4)2SO4,②NaNO3,③NH4HSO4,④NH4NO3,⑤CH3COONa溶液,它们的pH由小到大的排列顺序是
A.③①④②⑤ B.①③⑤④② C.③②①⑤④ D.⑤②④①③
难度: 简单查看答案及解析
-
下列说法不正确的是
A.镀锡的铁片镀层破损后,腐蚀速率加快
B. Fe在食盐水中被腐蚀,其负极反应为 O2 +2H2O + 4e- = 4OH-
C.可用被保护金属与直流电源负极相接的方法来减慢腐蚀速率
D.电解法精炼铜时,阳极材料应用粗铜
难度: 简单查看答案及解析
-
目前市场上的手提应急灯,主要是“无液干粉”铅蓄电池,其原理是将有腐蚀性的浓硫酸灌注到硅胶凝胶中去,使电解质溶液不易发生泄漏,大大改善了电池的性能。所用的原料仍然是铅硫酸二氧化铅。下列关于该铅蓄电池的说法正确的是
A.充电时电源的正极接铅蓄电池标“+”的一极
B.“无液干粉”铅蓄电池彻底改变了原来的铅蓄电池的原理
C.放电时在铅蓄电池的负极发生还原反应
D.充电时电池上标有“-”的极发生氧化反应
难度: 简单查看答案及解析
-
向一定体积的饱和石灰水中加入少量生石灰,并恢复到原状况。则下列叙述正确的是
A.溶液的pH增大 B.溶液的pH减小
C.溶液中Ca2+浓度保持不变 D.溶液中Ca2+物质的量保持不变
难度: 简单查看答案及解析
-
用标准NaOH溶液滴定未知浓度的盐酸溶液,下列操作会使测定结果偏低的是
A.配制NaOH标准液时,所用的NaOH固体中含有少量的KOH杂质
B.滴定前对碱式滴定管仰视读数,滴定后又俯视
C.滴定前,碱式滴定管尖嘴部分有气泡,滴定后气泡消失
D.碱式滴定管用蒸馏水洗净后,直接装入标准NaOH溶液
难度: 简单查看答案及解析
-
现有含少量FeSO4杂质的CuSO4溶液,欲提纯CuSO4溶液,则下列药品组合正确的是
A.Cl2、NaOHB.HClO 、氨水 C. H2O2 、CuOD.KMnO4 、Zn
难度: 简单查看答案及解析
-
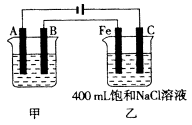
下图中乙是甲的电解池进行电解时某个量(纵坐标x)随时间变化的曲线(各电解池都用石墨作电极,不考虑电解过程中溶液浓度变化对电极反应的影响),则x表示

A.各电解池析出气体体积总数的变化 B.各电解池阳极质量的增加
C.各电解池阴极质量的增加 D.各电极上放电的离子总数的变化
难度: 简单查看答案及解析
-
已知一定温度下,2X(g)+Y(g)
mZ(g) ΔH=-a kJmol-1(a>0),现有甲、乙两容积相等且固定的密闭容器,在保持该温度恒定的条件下,向密闭容器甲中通入2 mol X和1 mol Y,达到平衡状态时,放出热量b kJ;向密闭容器乙中通入1 mol X和0.5 mol Y,达到平衡时,放出热量c kJ,且b>2c,则a、b、m的值或关系正确的是
A.m=4 B.a=bC.a< D.m≤2
难度: 简单查看答案及解析
-
将一元碱BOH的溶液与一元酸HA的溶液等体积混合,若所得溶液呈碱性,下列有关判断正确的是
A.若混合前酸、碱pH之和等于14,则HA肯定是弱酸
B.若混合前酸、碱物质的量浓度相同,则HA肯定是弱酸
C.溶液中水的电离程度:混合溶液>纯水>BOH溶液
D.混合溶液中离子浓度一定满足:c(B+)>c(A—)>c(H+)>c(OH—)
难度: 简单查看答案及解析
-
25 ℃下Ksp[Mg(OH)2]=5.6110-12 ,Ksp(MgF2)=7.4210-11 。下列说法正确的是
A.25 ℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的C(Mg2+)大
B.25 ℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,C(Mg2+)增大
C.25 ℃时,Mg(OH)2固体在20 mL 0.01 molL-1氨水中的Ksp比在20 mL 0.01molL-1NH4Cl溶液中的Ksp小
D.25 ℃时,在Mg(OH)2悬浊液中加入NaF溶液后,Mg(OH)2不可能转化为MgF2
难度: 简单查看答案及解析
-
缓冲溶液可以抗御少量酸碱对溶液pH的影响,Na2HPO4/Na3PO4的混合溶液可以将体系的pH稳定在11.3~13.3之间,是一种常用的缓冲溶液。下列有关该缓冲溶液的说法错误的是
A.加入少量强碱,主要发生的反应HPO42-+OH- PO43-+H2O
B.加入少量强酸,主要发生的反应HPO42-+2H+ H3PO4
C.c(Na+)+c(H+)=c(OH-)+c(H2PO )+2c(HPO )+3c(PO )
D. c(Na+)>c(PO )+c(HPO )+c(H2PO )+c(H3PO4)> c(Na+)
难度: 简单查看答案及解析
-
用惰性电极电解下列溶液一段时间后,停止电解,向溶液中加入一定质量的另一种物质(括号内),可能使溶液完全复原的是
A.CuCl2 (CuO) B.NaOH (NaOH)
C.CuSO4 (Cu(OH)2 ) D.NaCl (Cl2)
难度: 简单查看答案及解析
-
草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,向10 mL0.01 mol•L-1 NaHC2O4溶液中滴加0.01 mol•L-1 NaOH 溶液,随着NaOH溶 液体积的增加,溶液中离子浓度关系
正确的是
A.V(NaOH)=0时,c(H+)=110-2 mol•L-1
B. V(NaOH)=10 mL时,c(H+)=110-7 mol/L
C. V(NaOH)<10 mL时,不可能存在c(Na+)=2c(C2O42-)+c(HC2O4-)
D.V(NaOH)>10 mL时,c(Na+)>c(C2O42-)>c(HC2O4-)
难度: 简单查看答案及解析
-
某温度下在,密闭容器中发生如下可逆反应:2M(g)+N(g)
2E(g),若开始时只充入2 mol E(g),达平衡时,E的转化率为40%;若开始时充入2 mol M和1 mol N的混合气体,达平衡时混合气体的压强比起始时减少了
A.20% B.40%C.60% D.80%
难度: 简单查看答案及解析