-
下列说法中,不正确的是
A.李比希燃烧法、钠熔法、铜丝燃烧法、纸层析法都是元素定性分析法
B.红外光谱分析法常用来判断有机化合物中具有哪些基团
C.麦芽糖、乳糖、纤维二糖互为同分异构体,分子式都为C12H22O11
D.绿色荧光蛋白质(GFP)是高分子化合物,其水溶液有丁达尔效应
难度: 简单查看答案及解析
-
肯定属于同族元素且性质相似的是
A.原子核外电子排布式:A为1s22s2,B为1s2
B.结构示意图:A为
,B为
C.A原子基态时2p轨道上有1个未成对电子,B原子基态时3p轨道上也有1个未成对电子
D.A原子基态时2p轨道上有一对成对电子,B原子基态时3p轨道上也有一对成对电子
难度: 简单查看答案及解析
-
下列除去括号内杂质的有关操作方法不正确的是
A.淀粉溶液(葡萄糖):渗析
B.甲苯(苯酚):加浓溴水,过滤
C.甲醇溶液(甲酸):加NaOH溶液,蒸馏
D.肥皂液(甘油):加食盐搅拌、盐析、过滤
难度: 简单查看答案及解析
-
A、B是短周期元素,最外层电子排布式分别为msx,nsxnpx+1。A与B形成的离子化合物加蒸馏水溶解后可使酚酞试液变红,同时有气体逸出,该气体可使湿润的红色石蕊试纸变蓝,则该化合物的相对分子质量是
A..38 B.55 C.100 D.135
难度: 简单查看答案及解析
-
已知某元素的前8个电离 能(I1/kJ·mol-1):I1=577,I2=1820,I3=2740,I4=11600,I5=14800,I6=18400,I7=23400,I8=27500。该元素原子的最外层有几个电子?
A..1个 B.2个 C.3个 D.4个
难度: 简单查看答案及解析
-
下列各物质的同类别的同分异构体数目最多的是
A. C10H22O的醇 B. C10H20O的醛 C. C10H20O2的羧酸 D. C10H22
难度: 简单查看答案及解析
-
在“绿色化学工艺”中,理想状态是原子利用率为100%。在用CH3C≡CH合成CH2=C(CH3)COOCH3的过程中,欲使原子利用率达到最高,还需要的其它反应物有
A.CO和H2 B.CO2和H2O C.H2和CO2 D.CH3OH和H2
难度: 简单查看答案及解析
-
下列实验装置图正确的是

难度: 简单查看答案及解析
-
下列各项比较中正确的是
A.共价键极性CCl4>SiCl4 B.沸点CH3CH2OH>CH3CH2Cl
C.元素的电负性Ca>Mg D.晶格能KCl>NaCl
难度: 简单查看答案及解析
-
最近发现一种由钛原子和碳原子构成的气态团簇分子,如图所示,顶角和面心的原子是钛原子,棱的中心和体心的原子是碳原子,它的化学式是
A..TiC B.TiC2 C.Ti4C4 D.Ti14C13
难度: 简单查看答案及解析
-
下列说法中正确的是
A..将NaHSO4晶体加热熔融时有两种化学键断裂
B.水分子间因为存在氢键,所以加热至较高温度时也难以分解
C.根据金属晶体的共性可知金属键和离子键一样没有方向性和饱和性
D.以极性共价键形成的分子一定是极性分子
难度: 简单查看答案及解析
-
石墨能与熔融金属钾作用,形成石墨间隙化合物,K原子填充在石墨各层碳原子中。比较常见的石墨间隙化合物是青铜色的化合物,其化学式可写成CxK,其平面图形见图,则x值为
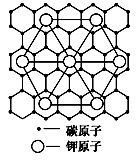
A.8 B.12 C.24 D.60
难度: 简单查看答案及解析
-
甘氨酸和丙氨酸的混合物在一定条件下发生反应生成的链状二肽的种数为
A.1 B.2 C.3 D.4
难度: 简单查看答案及解析
-
三位科学家因在烯烃复分解反应研究中的杰出贡献而荣获2005年度诺贝尔化学奖,烯烃复分解反应可示意如下:

下列化合物中,经过烯烃复分解反应可以生成
的是
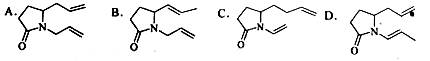
难度: 简单查看答案及解析
-
A和M为两种元素,已知A位于短周期,且A2-与M+的电子数之差为8,则下列说法正确的是
A.A和M原子的电子总数之和可能为11 B.A和M的原子序数之差为8
C.A和M原子的最外层电子数之和为8 D.A和M原子中未成对电子数相等
难度: 简单查看答案及解析
-
下列说法错误的是
A.在乙炔分子中存在的σ键数大于π键数
B.因为碳原子之间形成的σ键要比π键牢固,所以乙烯分子中碳碳双键的键能并不是乙烷分子中碳碳单键键能的2倍
C.氢分子中的化学键有方向性和饱和性
D.构成分子晶体的物质中可能没有化学键
难度: 简单查看答案及解析
-
.某芳香族有机物的分子式为C8H6O2,它的分子(除苯环外不含其他环)中不可能有
A.两个羟基 B.一个醛基 C.两个醛基 D.一个羧基
难度: 简单查看答案及解析
-
洋蓟素是一种新结构类型的抗乙型肝炎病毒和抗艾滋病病毒的化合物,其结构如下图所示,有关洋蓟素的说法正确的是
A.洋蓟素的分子组成为C25H22O12
B.该分子在1H核磁共振谱中有12个峰
C.1mol洋蓟素最多可与9mol NaOH反应
D.一定条件下能发生酯化反应、消去反应、能与氯化铁溶液发生显色反应,常温下能被空气氧化而变色。
难度: 简单查看答案及解析
-
下列各分子中,所有原子都满足最外层8 电子结构的是
A.CH4 B.COCl2 C. NO2 D. PCl5
难度: 简单查看答案及解析
-
某物质的结构为
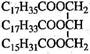 ,关于该物质的叙述正确的是
,关于该物质的叙述正确的是A.一定条件下与氢气反应可以生成硬脂酸甘油酯
B.一定条件下与氢气反应可以生成软脂酸甘油酯
C.与氢氧化钠溶液混合加热能得到肥皂的主要成分
D.与其互为同分异构且完全水解后产物相同的油脂有三种
难度: 简单查看答案及解析