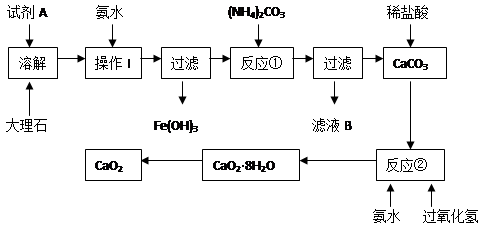
-
下列类型的反应,一定发生电子转移的是
A. 化合反应 B. 分解反应 C. 置换反应 D. 复分解反应
难度: 简单查看答案及解析
-
下列各组仪器: ①漏斗 ②容量瓶 ③滴定管 ④分液漏斗 ⑤天平 ⑥量筒 ⑦胶头滴管 ⑧蒸馏烧瓶。常用于物质分离的是
A. ①③⑦ B.②⑥⑦ C.①④⑧ D.④⑥⑧
难度: 简单查看答案及解析
-
下列有关金属的说法中,正确的是
①纯铁较生铁不易生锈 ②冶炼铝和钠都可以用电解法
③KSCN溶液可以检验Fe3+离子 ④缺钙会引起骨质疏松,缺铁会引起贫血
⑤青铜、不锈钢、硬铝都是合金 ⑥铜与硫反应,生成黑色的CuS
A.①②③④⑤ B.②③④⑤⑥ C.①③④⑤ D.①②③④⑤⑥
难度: 简单查看答案及解析
-
以下关于锂、钠、钾、铷、铯的叙述错误的是
①氢氧化物中碱性最强的是CsOH ②单质熔点最高的是铯
③它们都是热和电的良导体 ④它们的密度依次增大,均要保存在煤油中
⑤它们的还原性依次增强 ⑥它们对应离子的氧化性也依次增强
A.①③ B.②⑤ C.②④⑥ D.①③⑤
难度: 简单查看答案及解析
-
下列有关实验的叙述中,正确的是
A.容量瓶在使用前须用待配溶液润洗
B.将二氧化硫通入到紫色石蕊试液中,试液先变红后褪色
C.称量氢氧化钠固体时,应将氢氧化钠固体放在称量纸上称量
D.加热时,可将试管、蒸发皿、坩埚直接在酒精灯焰上加热
难度: 简单查看答案及解析
-
下列有关试剂存放的叙述正确的是
A. 氢氟酸或浓硝酸存放在带橡皮塞的棕色玻璃瓶中
B. 汽油或煤油存放在带橡皮塞的棕色玻璃瓶中
C. 碳酸钠溶液或氢氧化钙溶液存放在配有磨口塞的棕色玻璃瓶中
D. 氯水或硝酸银溶液存放在配有磨口塞的棕色玻璃瓶中
难度: 简单查看答案及解析
-
下列物质中:①Na2SiO3②Al(OH)3③NH4HCO3④Al2O3⑤NaHSO4既能与盐酸反应,又能与NaOH溶液反应的是
A.①②④ B.②④⑤ C.②③④ D.全部
难度: 简单查看答案及解析
-
下列说法正确的是
A.钠的金属活泼性大于铜,在溶液中钠可以置换出铜
B.使用托盘天平称量固体药品时左码右物,可能会导致所配溶液浓度偏低
C.碳、钠与O2反应时,由于O2的量不同,可分别生成CO、CO2和Na2O、Na2O2
D.工业上电解熔融MgCl2制取镁,也可电解熔融AlCl3制取铝
难度: 简单查看答案及解析
-
下列叙述正确的是
A.强电解质都是离子化合物,因此NaCl是离子化合物
B.硫磺是单质,不导电,因此硫磺是非电解质
C.SO3溶于水,其水溶液能导电,SO3是电解质
D.醋酸溶液的导电能力可能比稀硫酸强
难度: 简单查看答案及解析
-
下列各组物质的分类正确的是
①混合物:水玻璃、水银、水煤气
②电解质:明矾、冰醋酸、石膏
③酸性氧化物:CO2、CO、SO3
④同位素:1H、2H2、3H
⑤同素异形体:C80、金刚石、石墨
⑥干冰、液氯都是非电解质
A.①②③④⑤⑥ B.②④⑤⑥ C.②⑤⑥ D.②⑤
难度: 简单查看答案及解析
-
只用试管和胶头滴管无法区分的一组溶液是
A.KOH和AlCl3 B.AlCl3和氨水 C.NaAlO2和盐酸 D.Na2CO3和盐酸
难度: 简单查看答案及解析
-
下列分离或提纯物质的方法正确的是
A.用渗析的方法精制Fe(OH)3胶体
B.用过滤的方法除去NaCl溶液中含有的少量淀粉胶体
C.用溶解、过滤的方法提纯含有少量BaSO4的BaCO3
D.用加热→蒸发的方法可以除去粗盐中的CaCl2、MgCl2等杂质
难度: 简单查看答案及解析
-
已知反应:①Cl2 + 2KBr = 2KCl + Br2;②KClO3 + 6HCl = 3Cl2↑+ KCl + 3H2O;③2KBrO3 + Cl2 = Br2 +2KClO3下列说法正确的是:
A. 氧化性由强到弱的顺序为KBrO3 > KClO3 > Cl2 > Br2
B.①中KCl 是氧化产物,KBr 发生还原反应
C. ③中1mol氧化剂参加反应得到电子的物质的量为2mol
D. 反应②中氧化剂与还原剂的物质的量之比为1:6
难度: 简单查看答案及解析
-
为除去氯化铜溶液中混有的氯化亚铁得到纯净的氯化铜溶液,常先加入H2O2溶液将Fe2+全部氧化成Fe3+,然后再加入
A.NaOH溶液 B.氨水 C.CuO D.KSCN溶液
难度: 简单查看答案及解析
-
设NA表示阿伏加德罗常数的值。下列叙述正确的是
A.标准状况下,2.24 L苯中含有0.6NA个碳原子
B.常温常压下,22.4 L NO2气体中含有原子数为3NA
C.84g NaHCO3固体和106g Na2CO3固体中CO32−的数目均为NA
D.0.01 mol铝与足量的氢氧化钠溶液反应转移的电子数是0.03 NA
难度: 简单查看答案及解析
-
将足量的铝粉分别投入等物质的量浓度的NaOH溶液和盐酸中,待反应结束后,两者产生的气体在相同状况下占有相同的体积。下列叙述不正确的是
A.两反应中转移的电子数相等
B.消耗NaOH溶液和盐酸的体积不相等
C. 消耗铝的质量相等
D.反应后两溶液混合会产生白色沉淀且溶液中的溶质只有NaCl
难度: 简单查看答案及解析
-
我校化学兴趣小组做了一个如图所示的实验,发现烧杯中酸性KMnO4溶液褪色。若将烧杯中的溶液换成含有少量KSCN的FeCl2溶液,溶液显红色。则该条件下

A.生成的水分子化学性质比较活泼
B.H2燃烧生成了具有氧化性的物质
C.H2燃烧的产物中可能含有一定量的H2O2
D.H2被冷却为液态氢,液氢的水溶液具有还原性
难度: 简单查看答案及解析
-
已知硫酸铅难溶于水,也难溶于硝酸,却可溶于醋酸铵溶液中,形成无色的溶液,其离子方程式是:PbSO4+2Ac-=Pb(Ac)2+SO42-。当Pb(Ac)2(醋酸铅)水溶液中通入H2S时,有黑色沉淀PbS和弱电解质HAc生成。表示这个反应的有关离子方程式正确的是 (注:Ac—表示醋酸根)
A.Pb(Ac)2+H2S = PbS↓+2HAc B.Pb2++H2S = PbS↓+2H+
C.Pb2++2Ac-+H2S = PbS↓+2HAc D.Pb2++2Ac-+2H++S2- =PbS↓+2HAc
难度: 简单查看答案及解析
-
1mol过氧化钠与2mol碳酸氢钠固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质为
A.Na2CO3 B.Na2O2、Na2CO3
C.NaOH、Na2CO3 D.Na2O2、NaOH、Na2CO3
难度: 简单查看答案及解析
-
某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32−、SO42−、NO3−中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。
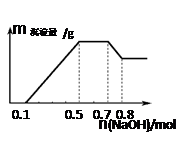
则下列说法正确的是
A、溶液中的阳离子只有H+、Mg2+、Al3+
B、溶液中n(NH4+)=0.2mol
C、溶液中一定不含CO32−,可能含有SO42−和NO3−
D、三种离子的物质的量之比:n(H+)∶n(Al3+)∶n(Mg2+) = 1∶1∶1
难度: 简单查看答案及解析
-
将硫酸铝溶液和氢氧化钠溶液等体积混合,得到的沉淀物中含铝元素的质量与溶液中含铝元素的质量相等,则原硫酸铝溶液和氢氧化钠溶液的物质的量之比可能是 ①1∶3 ②2∶3 ③1∶7 ④2∶7 ⑤任意比
A.②③ B.只有① C.②④ D.①③
难度: 简单查看答案及解析
-
14g铜金合金与足量的某浓度HNO3反应,将产生的气体用1.12L(标准状况)O2 混合,通入水中,气体恰好被完全吸收,则合金中铜的质量为
A.9.6g B.6.4g C.3.2g D.1.6g
难度: 简单查看答案及解析
-
向某稀HNO3和Fe(NO3)3的混合溶液中逐渐加入铁粉,产生无色气体,该气体遇空气变红棕色,溶液中Fe2+浓度和加入Fe粉的物质的量之间的关系如图所示。则稀溶液中HNO3和Fe(NO3)3的物质的量浓度之比为

A.2:1 B.4:1 C.1:1 D.3:1
难度: 简单查看答案及解析
-
某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列分析或结果错误的是

A.原混合酸中NO3-物质的量浓度 为2 mol/L
B.OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气
C.第二份溶液中最终溶质为FeSO4
D. H2SO4浓度为2.5 mol·L-1
难度: 简单查看答案及解析