-
下列有关描述正确的是( )
A. 第一电离能: B>Be>Li
B. 电负性: F>N>O
C. Br-的核外电子排布式为: [Ar]4s24p6
D. 基态Ni 原子的价电子排布图:

难度: 中等查看答案及解析
-
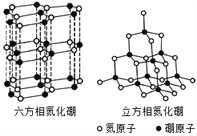
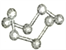
观察下列模型并结合有关信息,判断有关说法正确的是( )
B12结构单元
SF6分子
S8
HCN
结构模
型示意
图



备注
熔点1873 K
—
易溶于CS2
—
A. 单质硼属于原子晶体 B. SF6是由极性键构成的极性分子
C. 固态硫S8属于原子晶体 D. HCN的结构式为HC=N
难度: 中等查看答案及解析
-
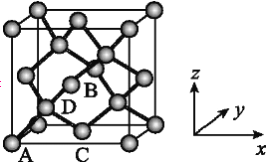
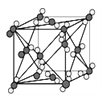
有关晶体的结构如下图所示,下列说法中不正确的是( )
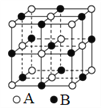


A. 在图1晶体中,距粒子B最近且等距的粒子A有6个
B. 在CO2晶体中,每个晶胞平均占有4个原子
C. 在金刚石晶体中,碳原子与碳碳键个数的比为1∶2
D. 该气态团簇分子的分子式为E4F4
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A. 邻羟基苯甲醛的熔、沸点比对羟基苯甲醛的熔、沸点低
B. 水很稳定是因为水中含有大量的氢键所
C. H2O、NH3、CH4分子中的O、N、C原子分别采取sp、sp2、sp3杂化
D. 配合物[Cu(H2O)4]SO4中,中心离子是Cu2+,配位体是SO42-,配位数是1
难度: 中等查看答案及解析
-
四种短周期元素W、X、Y、Z的原子序数依次增大。其原子的最外层电子数之和为19,W和X元素原子内质子数之比为l∶2,X2+和Z-的电子数之差为8。下列说法不正确的是( )
A. WY2是由极性键构成的非极性分子
B. 元素原子半径从大到小的顺序是X>Y>Z
C. WZ4分子中W、Z 原子通过共价键结合且最外层均达到8电子结构
D. Z 元素含氧酸有多种,其酸性:HZO>HZO3>HZO4
难度: 中等查看答案及解析
-
已知NO和O2转化为NO2的反应机理如下:
①2NO(g)
N2O2(g)(快) △H1<0平衡常数K1
②N2O2(g)+O2(g)
2NO2(g)(慢) △H2<0平衡常数K2

下列说法正确的是( )
A. 2NO(g)+O2(g)
2NO2(g)的△H=-(△H1+△H2)
B. 2NO(g)+O2(g)
2NO2(g)的平衡常数K= K1/K2
C. 反应②的速率大小决定2NO(g)+O2(g)
2NO2(g)的反应速率
D. 反应过程中的能量变化可用图a表示
难度: 中等查看答案及解析
-
下列关于化学反应的图像的说法不正确是 ( )
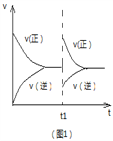
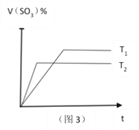
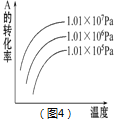
A. 图1可表示反应2NO2
N2O4 在等温等压条件下平衡后t1时刻充入NO2时反应速率变化
B. 图2可表示CO(g)+2H2(g)
CH3OH(g)在一定温度下,将0.5mol CO和0.5mol H2在体积为2L的密闭容器中发生反应时CO的体积分数随时间变化图像。
C. 图3可表示反应2SO2 +O2
2SO3 ,温度T1>T2,反应为吸热反应。
D. 图4可表示反应mA(g)+nB(g)
pC(g)+qD(g),正反应是吸热反应,且m+n>p+q。
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 加入少量硫酸铜可加快锌与稀硫酸的反应速率,说明Cu2+具有催化作用
B. CH3Clg)+Cl2(g)
CH2Cl2(l)+HCl(g)常温下能自发进行,则该反应的△H<0
C. 在恒温密闭容器中发生反应PCl3(g)+Cl2(g)
PCl5(s),当PCl3的体积分数不变时,反应达到平衡状态
D. 常温下pH=3的盐酸与pH=11的Ba(OH)2溶液等体积混合,溶液呈碱性
难度: 中等查看答案及解析
-
部分弱酸的电离平衡常数数据如下表,则下列选项正确的是( )
弱电解质
HCOOH
HCN
H2CO3
电离平衡常数
Ka=1.77×10-4
Ka=4.9×10-10
Ka1=4.3×10-7Ka2=5.6×10-11
A. 向NaCN溶液中通入CO2发生反应:2CN-+H2O+CO2=2HCN+CO32-
B. 相同物质的量浓度的HCOONa、NaCN、Na2CO3溶液,pH值大小为:NaCN>Na2CO3>HCOONa
C. 等体积等浓度的HCOONa和NaCN溶液中所含离子总数前者大于后者
D. 中和等体积、等pH的HCOOH和HCN,消耗NaOH的物质的量前者大于后者
难度: 困难查看答案及解析
-
已知: ①298K时K(HF)=3.5×10-4,Ksp(CaF2)= 1.8×10-7
②HF(aq)
H+(aq)+F-(aq) △H<0
根据以上已知信息判断下列说法正确的是( )
A. 298K时,加蒸馏水稀释HF溶液,
保持不变
B. 308K时,HF的电离常数Ka>3.5×10-4
C. 298K时,向饱和CaF2溶液中加入少量CaCl2,Ksp(CaF2)会减小
D. 2HF(aq)+Ca2+(aq)
CaF2(s)+2H+(aq) K≈0.68
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A. 95℃纯水的pH<7,说明加热可导致水呈酸性
B. pH=3的醋酸溶液,稀释至10 倍后pH=4
C. pH均为3,等体积的醋酸和盐酸分别与足量Zn反应,醋酸产生的H2多
D. pH=3 的醋酸溶液,与pH=11的氢氧化钠溶液等体积混合后pH>7
难度: 中等查看答案及解析
-
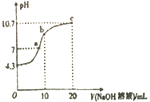
改变0.1mol·L-1二元弱酸H2A溶液的pH, 溶液中的H2A、HA-、A2-的物质的量分数∮(X)随pH的变化如图所示[已知:∮(X)=
]。下列叙述错误的是( )
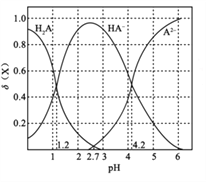
A. pH=1.2 时,c (H2A)=c(HA-) B. lg[K2(H2A)]=-4.2
C. pH=2.7时,c(HA-) >c(H2A)=c(A2-) D. pH=4.2时,c (HA-)=c(A2-)=c(H+)
难度: 困难查看答案及解析
-
某兴趣小组同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,盐桥中装有饱和溶液。下列说法正确的是( )
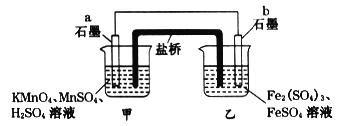
A. a电极上发生的反应为:MnO4-+8H++5e-═Mn2++4H2O
B. 外电路电子的流向是从a到b
C. 电池工作时,盐桥中的SO42-移向甲烧杯
D. b电极上发生还原反应
难度: 困难查看答案及解析
-
清华大学首创三室膜电解法制备LiOH,其工作原理如图。下列说法正确的是( )
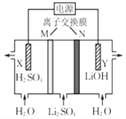
A. N为阳离子交换膜 B. X 电极连接电源负极
C. 制备2.4gLiOH产生2.24LH2(标况) D. Y 电极反应式为O2+2H2O+4e-=4OH-
难度: 中等查看答案及解析
-
关于下列各图说法正确的是( )
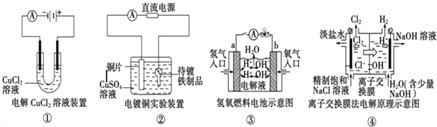
A. 装置①中阳极上析出红色固体
B. 装置②中待镀铁制品应与电源的正极相连
C. 装置③中外电路电子由b极流向a极
D. 装置④中离子交换膜可以避免氯气与氢氧化钠溶液反应
难度: 中等查看答案及解析
-
某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。下列说法正确的是( )
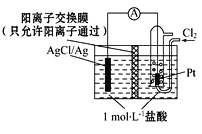
A. 正极反应为AgCl+e-=Ag + Cl-
B. 放电时,交换膜右侧溶液中有大量白色沉淀生成
C. 若用NaCl溶液代替盐酸,则电池总反应随之改变
D. 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
难度: 困难查看答案及解析
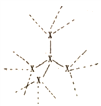 ,每个X原子周围都与4个X成键形成的庞大结构);化合物XO2结构为(
,每个X原子周围都与4个X成键形成的庞大结构);化合物XO2结构为( ,每个X与4个O成键,每个O都与2个X成键形成的庞大结构)。
,每个X与4个O成键,每个O都与2个X成键形成的庞大结构)。