-
W、M、X、Y、Z为原子序数依次增大的前四周期元素,非金属元素W所在周期数等于族序数;M最外层电子数是电子层数的两倍;X与M同族,X单质与O2反应生成化合物XO2;Y 是第三周期原子半径最小的元素;Z是生活中常见金属,既不属于主族,也不属于副族。回答下列问题:
(1) W与M可以形成多种化合物,写出其中最简单化合物的电子式_____________。
(2) 已知:①X的单质结构为(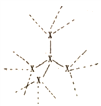 ,每个X原子周围都与4个X成键形成的庞大结构);化合物XO2结构为(
,每个X原子周围都与4个X成键形成的庞大结构);化合物XO2结构为(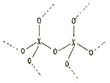 ,每个X与4个O成键,每个O都与2个X成键形成的庞大结构)。
,每个X与4个O成键,每个O都与2个X成键形成的庞大结构)。
②有关键能的数据如下表:
| 化学键 | X-O | O=O | X-X |
| 键能(kJ/mol) | 460 | 498.8 | 176 |
写出单质X 在O2中燃烧的热化学方程式________________________。(用具体元素符号书写方程式)
(3) 写出Z的单质与H2O反应的化学方程式_____________________________________。
(4)Y和Z形成的化合物的水溶液呈酸性的原因_______________________________(用离子方程式解释)。
-
X、Y、Z、W是原子序数依次增大的短周期主族元素。Y与W同主族,Z所在的族序数等于周期数,X、Y最外层电子数之和为7;X、Z原子的电子数总和与Y、W原子的电子数总和之比为7:12。下列说法正确的是( )
A. 原子半径:r(X)<r(Y)<r(Z)<r(W)
B. Y的简单气态氢化物的热稳定性比W的弱
C. 由X、Y组成的物质与由Y、W组成的物质化合,可能发生氧化还原反应
D. 常温下,Z的单质一定易溶于由X、Y、W三种元素组成的化合物的溶液
-
短周期主族元素A、B、C、D的原子序数依次增大。A、C的原子序数之差为8,A、B、C三种元素原子的最外层电子数之和为15,B原子最外层电子数等于A原子最外层电子数的一半。下列叙述正确的是
A.非金属性:A>C
B.原子半径:B<C<D
C.最高价氧化物对应水化物的酸性:D<C
D.单质B常温下能溶于浓硝酸
-
A、B、D、E、F为原子序数依次增大的五种短周期主族元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B单质在D单质中充分燃烧能生成其最高价化合物BD2。E+与D2-具有相同的电子数。A单质在F单质中燃烧,产物溶于水得到一种强酸。用相应的化学用语回答下列问题:
(1)A在周期表中的位置是 。AFD的电子式为 。
(2)BD2的结构式为 ; BD2形成晶体的类型为 。
(3)元素D、E 、F形成的简单离子的半径由大到小为 (用离子符号表示)。
(4)写出实验室制备单质F的离子方程式 。
(5)写出E与D形成的既含离子键又含共价键的化合物与水反应的化学方程式 。
-
A、B、D、E、F为原子序数依次增大的五种短周期主族元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B单质在D单质中充分燃烧能生成其最高价化合物BD2。E+与D2-具有相同的电子数。A单质在F单质中燃烧,产物溶于水得到一种强酸。用相应的化学用语回答下列问题:
(1)A在周期表中的位置是 。AFD的电子式为 。
(2) BD2的结构式为 ; BD2形成晶体的类型为 。
(3)元素D、E 、F形成的简单离子的半径由大到小为 (用离子符号表示)。
(4)写出实验室制备单质F的离子方程式 。
(5)写出E与D形成的既含离子键又含共价键的化合物与水反应的化学方程式 。
-
短周期主族元素X、Y、Z、W原子序数依次增大,X原子最外层有6个电子,Y是至今发现的非金属性最强的元素,Z在周期表中处于周期序数等于族序数的位置,W的单质广泛用作半导体材料。下列叙述正确的是
A. 原子最外层电子数由多到少的顺序:Y、X、W、Z
B. 原子半径由大到小的顺序:W、Z、Y、X
C. 元素非金属性由强到弱的顺序:Z、W、X
D. 简单气态氢化物的稳定性由强到弱的顺序:X、Y、W
-
短周期元素X、Y、Z、W 的原子序数依次增大,它们的原子最外层电子数为互不相等的奇数,且X、Y、W 原子最外层电子数之和恰好等于Z元素的核电荷数,X与W的最高化合价之和为8,Z是使用最广泛的短周期金属元素,下列说法不正确的是( )
A. Y、Z形成的一种化合物强度高、热膨胀系数小,是良好的耐热冲击材料
B. Z的氧化物熔点很高,故工业上常用电解熔融ZW3的方法制取单质Z
C. 离子化合物YX5若存在,YX5与水反应生成气体X2,同时得到一种弱碱溶液
D. 化合物YW3遇水能强烈水解,产物之一具有强氧化性
-
短周期主族元素X、Y、Z、W原子序数依次增大,X原子最外层有6个电子,Y是至今发现的非金属性最强的元素且无正价,Z在周期表中处于周期序数等于族序数的位置,W的单质广泛用作半导体材料.下列叙述正确的是( )
A. 原子半径由大到小的顺序:W、Z、Y、X
B. 原子最外层电子数由多到少的顺序:Y、X、W、Z
C. 元素非金属性由强到弱的顺序:Z、W、X
D. 简单气态氢化物的稳定性由强到弱的顺序:X、Y、W
-
短周期元素X、Y、Z、W的原子序数依次增大,它们的原子最外层电子数为互不相等的奇数,且X、Y、W原子最外层电子数之和恰好等于Z元素的核电荷数,X与W的最高化合价之和为8,常见金属元素Z的一种核素的质量数为28,中子数比质子数多2。下列说法中正确的是( )
A. 用“百度”搜索知,Y、Z形成的化合物“室温下强度高,……。导热性好,热膨胀系数小,是良好的耐热冲击材料。”由此可推测该化合物属于离子晶体
B. 化合物YW3水解产物之一具有强氧化性,由此可知Y在该化合物中的化合价为+3
C. 由非金属元素组成的化合物YX5是一种是否存在尚待确证的化合物,假如存在,该物质与水反应必然生成气体X2,同时得到一种弱碱溶液
D. 因为Z的氧化物熔点很高,不适宜于电解,故工业上常用电解Z与W的化合物的方法制取
-
A、B、C、D、E为原子序数依次增大的五种短周期元素,其中仅有一种金属元素,A和D最外层电子数相同;B和C在周期表中相邻,C和E同主族;B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的液态化合物。下列说法不正确的是
A. C、D、E三种原子对应的离子半径由大到小的顺序:E>C>D
B. 由A、B、C三种元素按原子个数比4∶2∶3组成的化合物所含的化学键只有离子键
C. A、C两种元素的单质与熔融的K2CO3组成的燃料电池,其负极反应式为H2-2e-+CO32-=CO2+H2O
D. 通过比较C和E两种元素气态氢化物的热稳定性可以确定两种元素非金属性相对强弱
 ,每个X原子周围都与4个X成键形成的庞大结构);化合物XO2结构为(
,每个X原子周围都与4个X成键形成的庞大结构);化合物XO2结构为( ,每个X与4个O成键,每个O都与2个X成键形成的庞大结构)。
,每个X与4个O成键,每个O都与2个X成键形成的庞大结构)。