-
某原子核外共有6个电子,分布在K与L电子层上,其原子在L层分布中能量最低的是( )
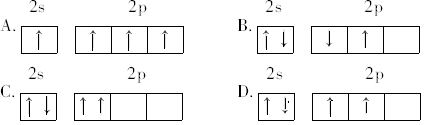
难度: 简单查看答案及解析
-
下列说法错误的是( )
A.ns电子的能量不一定高于(n-1)p电子的能量
B.6C的电子排布式1s22s22px2违反了洪特规则
C.电子排布式(21Sc)1s22s22p63s23p63d3违反了能量最低原理
D.电子排布式(22Ti)1s22s22p63s23p10违反了泡利原理
难度: 简单查看答案及解析
-
下列各组原子中,彼此化学性质一定相似 的是 ( )
A、 原子核外电子排布式为l s2的X原子与原子核外电子排布式为l s2 2s2的Y原子
B.原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子
C.2p轨道上有一个空轨道的X原子与3p轨道上有一个空 轨道的Y原子
D.最外层都只有一个电子的X、Y原子
难度: 简单查看答案及解析
-
甲苯的二氯代物的结构可能有( )
A、8种 B、9种 C、10 种 D、11种
难度: 简单查看答案及解析
-
下列各组中的反应,属于同一反应类型的是( )
A.由溴丙烷水解制丙醇;由丙烯与水反应制丙醇
B.由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸
C.由氯代环己烷消去制环己烯;由丙烯加溴制
二溴丙烷
D.由乙酸和乙醇制乙酸乙酯;由苯甲酸乙酯水解制苯甲酸和乙醇
难度: 简单查看答案及解析
-
足量锌投入到1L14mol/L浓硫酸中充分反应,经测定没有硫酸剩余则此过程转移的电子数( )
A、大于14NA B、 等于14NA C、 小于14NA D、无法确定
难度: 简单查看答案及解析
-
NA代表阿伏加德罗常数,下列说法正确的是( )
A、12.4g白磷含有的P—P键数目为0.4NA
B、15.6gNa2O2与过量的CO2反应时,转移的电子数为0.4NA
C、标准状况下,a L甲烷和乙烷混合气体中的分子数为a NA /22.4
D、5.6 g铁粉与硝酸完全反应失去的电子数一定为0.3NA
难度: 简单查看答案及解析
-
下列说法正确的是( )
A、含n molHCl的浓盐酸与足量MnO2反应可生成n NA /4 个氯分子( )
B、在密闭容器中建立了N2+3H2
2NH3的平衡,每有17gNH3生成,必有0.5NA个NH3分子分解
C、同温同压同体积的CO2和SO2所含氧原子数均为2NA
D、20 g重水(D2O)中含有的电子数为10NA
难度: 简单查看答案及解析
-
A、B、C、D四种元素,已知A元素是地壳中含量最多的元素;B元素为金属元素,它的原子核外K、L层上电子数之和等于M、N层电子数之和;C元素是第三周期第一电离能最小的元素;D元素在第三周期中第一电离能最大。下列有关叙述错误的是 ( )
A四种元素A、B、C、D分别为O、Ca、Na、Ar
B.元素A、B、C两两组成的化合物可为CaO、Ca02、Na2 0、 Na2 02等
C元素A、C简单离子的半径大小关系为A<C
D-元素A、C电负性大小关系为A>C
难度: 简单查看答案及解析
-
现有四种元素的基态原子的电子排布式如下:
①l s2 2s2 2p6 3s2 3p4 ②l s2 2s2 2p6 3s2 3p3 ③1s2 2s2 2p3④1 s2 2s2 2p5
则下列有关比较中正确的是 ( )
A、第一电离能:④>③>②>① B.原子半径:④>③>②>①
C.电负性:④>③>②>①D.最高正化合价:④>③=②>①
难度: 简单查看答案及解析
-
用价层电子对互斥理论预测H2S和BF3的立体结构.两个结论都正确的是
A、直线形;三角锥形 B.V形;三角锥形
C.直线形;平面三角形 D.V形;平面三角形
难度: 简单查看答案及解析
-
下列各组分子中,都属于含极性键的非极性分子的是 ( )
A、C02、H2S B 、C2H4、CH4 C.Cl2、C2H2 D、NH3、HCl
难度: 简单查看答案及解析
-
下列叙述正确的是
A.分子晶体中都存在共价键
B.F2、C12、Br2、I2的熔沸点逐渐升高与分子间作用力有关
C.含有极性键的化合物分子一定不含非极性键
D.只要是离子化合物,其熔点一定比共价化合物的熔点高
难度: 简单查看答案及解析
-
下列物质的熔、沸点高低顺序中,正确的是
A.金刚石 >晶体硅 >二氧化硅 >碳化硅 B.CI4>CBr4>CCl4>CH4
C.MgO>O2>N2>H2O D.金刚石>生铁>纯铁>钠
难度: 简单查看答案及解析
-
关于氢键,下列说法正确的是
A.每一个水分子内含有两个氢键 B.冰、水和水蒸气中都存在氢键
C.水的熔点比H2S高 D.由于氢键作用,H2O是一种非常稳定的化合物
难度: 简单查看答案及解析