-
A、B、C、D、E都是元素周期表中的前20号元素,它们的原子序数依次递增。已知B、D两种元素原子的最外层电子数是最内层电子数的两倍,而C元素原子的最外层电子数等于B元素原子的核外电子数,E的价电子数为1.回答下列问题。
(1)画出C元素的原子结构示意图_______。
(2)在1mol DC2中,有___mol D—C键。
(3)在化合物BC2的晶体中,每个BC2分子周围与它距离最近的BC2分子有___个。
(4)原子序数介于B、C之间的元素X和B、C都可与A形成10e-的化合物。则X、B、C的第一电离能顺序是_____(填元素符号),三种10e-的化合物中沸点最低的___。
(5)已知高温下C和E元素形成的晶体呈立方体结构,晶体中元素C的化合价部分为0价,部分为-2价。如下图所示为C和E元素形成的晶体的一个晶胞(晶体中最小的重复单元),则下列说法中正确的是__________。
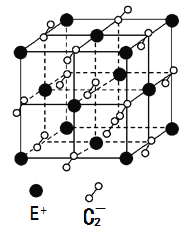
A.该晶体化学式为EC2(KO2),每个晶胞含有个4个E+和4个C2-
B.晶体中每个E+周围有8个C2-,每个C2-周围有8个E+
C.晶体中与每个E+距离最近的E+有8个
D.晶体中,0价C与-2价C的数目比为3:1
E.C2-与N2互为等电子体
-
[选修物质结构与性质](15分)
A、B、C、D、E、F为六种短周期元素,它们核电荷数依次递增。已知:B原子核外最外层电子数是次外层电子数的两倍,电子总数是E原子总数的1/2,F是同周期元素中原子半径最小的元素;D2-与E2+的电子层结构相同。B与D可以形成三原子化合物甲。A是非金属元素,且A、C、F可形成离子化合物乙。请回答:
(1)C单质的电子式________,F元素原子的电子排布式________,E元素的原子结构示意图是________。
(2)化合物乙中含有的化学键是________。
(3)化合物甲为固体时属于________晶体,E单质在一定条件下与甲反应的化学方程式为________。
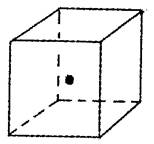
(4)如图立方体中心的“·”表示B单质所形成的原子晶体中的一个原子,请在立方体的顶点用“·”表示出与之紧邻的B原子
-
Q、X、Y、Z、W 五种元素的原子序数依次递增,W 为第四周期元素,其余均为短周期主族元素,已知:
①Q原子的最外层电子数是次外层电子数的2 倍
②Y、Z同主族,Y原子价电子排布图为 ;
;
③W元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子。
请回答下列问题:
(1)基态Q 原子中,电子运动状态有_____种,电子占据的最高能级符号为_____,该能级含有的轨道数为________。
(2)W的元素符号为_____,其基态原子的电子排布式为________。
(3)具有相同价电子数和相同原子数的分子或离子具有相同的结构特征,这一原理称为“等电子原理”,五种元素中电负性最强的非金属元素形成的一种单质A 与Y.Z 形成的化合物B 是等电子体物质,A、B分子式分别为______、_______。
(4)Q、X、Y三种元素的第一电离能数值最大的是_____(用元素符号作答),原因是______。
-
短周期元素A、B、C,原子序数依次递增.已知:A、C同主族,而且三种元素原子的最外层电子数之和为15,B原子最外层电子数等于A原子最外层电子数的一半.下列叙述正确的是( )
A.原子半径:A<B<C
B.沸点:A的氢化物低于C的氢化物
C.常温下,B的硫酸盐溶液pH<7
D.5.6g铁与足量的C化合,转移0.3mol电子
-
X、Y、Z、M、N是元素周期表中的短周期主族元素,且原子序数依次递增。已知X的最外层电子数是次外层电子数的3倍,X、M同主族,Y在同周期主族元素中原子半径最大,Z的最高化合价与最低化合价的代数和为零。下列说法正确的是
A. 单质的氧化性:X<M
B. 气态氢化物的热稳定性:M>N
C. X与Y简单离子半径:r(X离子)<r(Y离子)
D. 化合物ZX2与ZN4含有相同类型的化学键
-
短周期元素A、B、C,原子序数依次递增。已知:A、C同主族,而且三种元素原子的最外层电子数之和为15,B原子最外层电子数等于A原子最外层电子数的一半。下列叙述正确的是 ( )
A.原子半径:A<B<C
B.沸点:A的氢化物低于C的氢化物
C.常温下,B的硫酸盐溶液pH<7
D.5.6 g铁与足量的C化合,转移0.3 mol电子
-
A、B、C、D、E是五种原子序数依次递增的短周期元素,已知:其中只有一种是金属元素;A和D元素的原子最外层电子数相同,C、E同主族,且E元素原子质子数是C元素原子质子数的2倍;B的最外层电子数是电子层数的两倍;C、A可形成两种常见的液态化合物甲和乙,且相对分子质量乙比甲大16。
(1)E元素的名称为: ;D的原子结构示意图为 。
(2)化合物乙中含有的化学键是 (填“极性共价键”或“非极性共价键”)。
(3)A单质与B、C形成的化合物可合成一种新型汽车动力燃料甲醇。
已知CO(g)+1/2O2(g)=CO2(g)
ΔH=-283 kJ/mol
H2(g)+1/2O2(g)===H2O(g) ΔH=-242 kJ/mol
CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g)
ΔH=-651 kJ/mol
写出A与所选化合物合成甲醇的热化学方程式: 。
(4)EC2与C、D形成的化合物发生氧化还原反应的化学方程式为: 。
-
(15分)现有A、B、C、D四种原子序数依次递增的短周期元素,E是常见的金属元素。已知A的最外层只有一个电子,B的最外层电子数是次外的三倍,C与A的最外层电子数相同,D与B是同主族元素。化合物甲是由A、B、C三种元素组成,化合物乙B、D、E三种元素组成,甲乙两种溶液混合有蓝色沉淀产生。化合物丙和丁都由B、C、D三种元素组成,且丙的相对分子质量比丁大16。请回答下列问题。
(1)画出C的原子结构示意图________,指出D在周期表中的位置________。
(2)写出丙和丁的化学式,丙________,丁________。鉴别丙的阴离子的方法是________。
(3)写出以Mg、Al为电极材料,以甲为电解质溶液所组成的原电池,负极的电极反应式________。
(4)若用石墨为电极,在250C时,电解200mL乙的溶液,当阴极增重6.4g,则反应后溶液的PH=________(设反应后溶液的体积仍为200mL);若以铜作电极,电解乙的水溶液,当外电路通过0.2mol电子时,理论上两极质量相差________g。
-
 、
、 、
、 、
、 、
、 五种元素的原子序数依次递增。已知:①
五种元素的原子序数依次递增。已知:① 位于周期表中第四周期
位于周期表中第四周期 族,其余的均为短周期主族元素:②
族,其余的均为短周期主族元素:② 的氧化物是光导纤维的主要成分;③
的氧化物是光导纤维的主要成分;③ 原子核外
原子核外 层电子数为奇数;④
层电子数为奇数;④ 是形成化合物种类最多的元素;⑤
是形成化合物种类最多的元素;⑤ 原子
原子 轨道的电子数为4。请回答下列问题:
轨道的电子数为4。请回答下列问题:
(1)写出一种 元素形成氢化物的化学式_____________。
元素形成氢化物的化学式_____________。
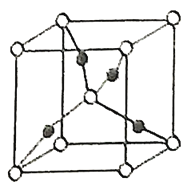
(2)在1个由 与
与 形成的
形成的 晶胞中(结构如图所示)所包含的
晶胞中(结构如图所示)所包含的 原子数目为____________个。
原子数目为____________个。
(3)在[F(NH3)4]2+离子中, 的空轨道接受
的空轨道接受 的氮原子提供的__________形成配位键。
的氮原子提供的__________形成配位键。
(4)常温下 、
、 和氢元素按原子数目1:1:2形成的气态常见物质
和氢元素按原子数目1:1:2形成的气态常见物质 是__________(写名称),
是__________(写名称), 物质分子中
物质分子中 原子轨道的杂化类型为__________,
原子轨道的杂化类型为__________, 分子中
分子中 键的数目为__________
键的数目为__________ 。
。
(5) 、
、 、
、 三种元素的第一电离能数值由小到大的顺序为__________(写元素符号)。
三种元素的第一电离能数值由小到大的顺序为__________(写元素符号)。
-
(10分)A、B、C、D、E原子序数依次递增的五种短周期元素,已知:
①B原子核外电子总数与最外层电子数之比为4:3
②D原子最外层电子数与次外层电子数之比为3:4
③E-,C+,A+的离子半径逐渐减小
④A单质在E单质中燃烧火焰呈苍白色
请回答下列问题:
(1)E的最高价氧化物对应水化物的化学式为:___________。它的酸性比D的最高价氧化物对应水化物的酸性:____________。(填“强”或“弱”)
(2)X、Y是由上述元素中任意3种组成的强电解质,且构成的原子个数比均为1:1:1。已知X溶液中水电离出来的C(H+)=10-12mol/L,则X的电子式为:_____________;Y的水溶液酸碱性与X相同,则其原因是(写离子方程式):_______________________________;
(3)B与C构成原子个数比为1:1的化合物与H2O反应的化学方程式为:_________________________________________________________;
(4)A与B,A与D均可形成18个电子的分子,这两种分子在水溶液中反应生成物之一是含10电子的化合物;该反应可观察到现象是:____________________________________,原因是(用化学方程式表示)_______________________________________________。





