-
化学在生产和日常生活中有着重要的应用。下列说法不正确的是( )
A.明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
B.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
C.“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”都能提高空气质量
D.电解MgCl2溶液,可制得金属镁
难度: 中等查看答案及解析
-
设NA代表阿伏加德罗常数的数值,下列说法正确的是( )
A.12.5mL 16mol·L-1浓硫酸与足量锌反应,转移电子数为0.2NA
B.0.1 mol24Mg18O晶体中所含中子总数为2.0 NA
C.1L 1 mol·L-1的醋酸溶液中离子总数为2NA
D.4.5 g SiO2晶体中含有的硅氧键数目为0.3 NA
难度: 中等查看答案及解析
-
下列离子方程式不正确的是( )
A.用稀硫酸除去铜绿:4H++Cu2(OH)2CO3=2Cu2++CO2↑+3H2O
B.将Na2O2固体投入H218O中:2H218O+2Na2O2=4OH-+4Na++18O2↑
C.向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42—完全沉淀:
2Ba2++NH4++Al3++2SO42—+4OH-= Al(OH)3↓+NH3·H2O+2BaSO4↓
D.向Na2FeO4溶液中加入稀硫酸产生氧气:4FeO42—+20H+ = 4Fe3++3O2↑+10H2O
难度: 困难查看答案及解析
-
下列推断正确的是( )
A.SiO2 虽是酸性氧化物,但其不溶于水,因此不能与NaOH溶液反应
B.Na2O、Na2O2组成元素虽然相同,但与H2O、CO2等反应的产物不完全相同
C.CO、SO2、NO、NO2都是对大气产生污染的气体,他们在空气中都能稳定存在
D.新制氯水显酸性,因此向其中滴加少量紫色石蕊试液,充分振荡后溶液最终会呈红色
难度: 中等查看答案及解析
-
E、F、G、M是原子序数依次增大的短周期主族元素,E、G在周期表中的相对位置如下表。已知E元素最低负化合价的绝对值与其原子最外层电子数相等,F是地壳中含量最多的金属元素。下列说法错误的是( )
E
G
A.E和氢组成的化合物分子中只含有极性共价键
B.工业上用电解熔融的F的氧化物方法来制备F
C.G、M两元素的气态氢化物中,M的气态氢化物更稳定
D.E、F、G、M元素最高价氧化物对应的水化物中酸性最强的是M的最高价含氧酸
难度: 困难查看答案及解析
-
一定条件下,充分燃烧一定量的丁烷放出QkJ的热量,经测定完全吸收生成的二氧化碳需消耗5 mol·L-1的KOH溶液100 mL,恰好生成正盐。则此条件下反应C4H10(g)+13/2O2(g) = 4CO2(g)+5H2O(g)的ΔH为( )
A.+8Q kJ·mol-1 B.+16Q kJ·mol-1 C.-8Q kJ·mol-1 D.-16Q kJ·mol-1
难度: 中等查看答案及解析
-
下列有关物质结构和性质的说法中,正确的是( )
A.因为水溶液的酸性:HCl>H2S,所以非金属性:Cl>S
B.同周期第ⅡA族与第IIIA族的元素原子序数之差不一定为1
C.元素原子的最外层电子数越多,越容易得电子,非金属性越强
D.同周期主族元素的原子形成的简单离子电子层结构相同
难度: 中等查看答案及解析
-
已知CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-Q1 ①
2H2(g)+O2(g)=2H2O(g) ΔH=-Q2 ②
H2O(g)=H2O(l) ΔH=-Q3 ③
常温下,取体积比为4∶1的甲烷和H2的混合气体112 L(标准状况下),经完全燃烧后恢复到常温,则放出的热量为( )
A.4Q1+0.5Q2 B.4Q1+Q2+10Q3 C.4Q1+0.5Q2+9Q3 D.4Q1+2Q2
难度: 中等查看答案及解析
-
将Mg、Cu组成的混合物26.4g投入到适量的稀硝酸中,固体完全溶解,收集到标准状况下的NO气体8.96L(无其他还原产物),向反应后的溶液中加入过量的5mol·L-1的NaOH溶液300mL,金属离子完全沉淀。则形成沉淀的质量是( )
A.43.2g B.46.8g C.53.6g D.63.8g
难度: 中等查看答案及解析
-
有关热化学方程式书写与对应表述均正确的是( )
A.稀硫酸与0.1 mol·L-1NaOH溶液反应:H+(aq)+OH-(aq)= H2O(l) △H = -57.3 kJ·mol-1
B.在101KPa下氢气的燃烧热△H =-285.5 kJ·mol-1, 则水分解的热化学方程式: 2H2O(l)=2H2(g)+O2(g) △H = +285.5 kJ·mol-1
C.已知2C(s)+O2(g)=2CO(g) △H=-221 kJ·mol-1, 则可知C的燃烧热为110.5 kJ·mol-1
D.1mol氢气完全燃烧生成液态水放热为285.8kJ,则氢气燃烧的热化学方程式为
2H2(g)+O2(g)=2H2O(g) △ H=-285.8 kJ· mol-1
难度: 中等查看答案及解析
-
正确掌握化学用语和化学基本概念是学好化学的基础,下列有关表述中正确的一项是( )
A.蔗糖与醋酸的最简式相同
B.16O与18O互为同位素,H216O、D216O、H218O、D218O互为同素异形体
C.SiH4、CH4、
粒子的空间构型为正四面体型;CO2、C2H2均为直线型分子
D.Ca2+的结构示意图为
;NH4Cl的电子式为
难度: 中等查看答案及解析
-
下列图示实验合理的是( )
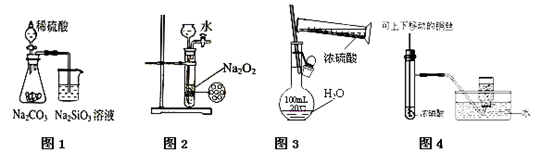
A.图1为证明非金属性强弱:
B.图2为制备少量氧气
C.图3为配制一定物质的量浓度的硫酸溶液
D.图4为制备并收集少量NO2气体
难度: 中等查看答案及解析
-
下列说法或表达正确的是( )
①活性炭、SO2和HClO都具有漂白作用,且漂白的化学原理相同
②向100mL0.1mol/L 的溴化亚铁溶液中通入0.05mol的氯气时发生反应的离子方程式:
2Fe2++4Br-+3Cl2=2 Fe3++2Br2+6Cl-
③因为氧化性:HClO>稀H2SO4,所以非金属性:Cl>S
④酸性条件下KIO3溶液与KI溶液发生反应生成I2时的离子方程式:
IO3-+5I-+3H2O=I2+6OH-
⑤碳酸氢根离子的电离方程式可表示为:
⑥元素周期表中,从上到下,卤族元素的非金属性逐渐减弱,氢卤酸的酸性依次减弱
⑦500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)
2NH3 (g) △H=-38.6kJ·mol-1
A.全部 B.②⑤ C.②③④⑦ D.②④⑦
难度: 困难查看答案及解析
-
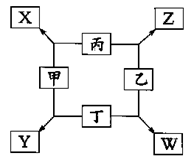
中学常见物质A、B、C、D、E、X,存在下图转化关系 (部分生成物和反应条件略去),下列推断不正确的是( )

A.若D是一种白色沉淀,在空气中最终变为红褐色,则A可能是铁
B.若D是一种强碱,则A、B、C均可与X反应生成D
C.若D为NaCl,且A可与C反应生成B,则E可能是CO2
D.若D是一种强酸,则A既可以是单质,也可以是化合物,且D可能与铜反应生成B或C
难度: 困难查看答案及解析
-
SCl6是一种无色的很稳定的物质,可用于灭火。SCl6的分子结构如图所示,呈正八面体型。如果氯元素有两种稳定的同位素,则SCl6的不同的分子种数为( )
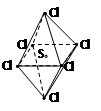
A.6 B.7 C.10 D.12
难度: 中等查看答案及解析
-
把一块镁铝合金投入到1mol/L 盐酸里,待合金完全溶解后,往溶液里加入1mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如下图A所示。下列说法中不正确的是( )
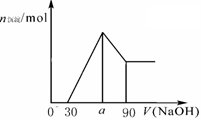
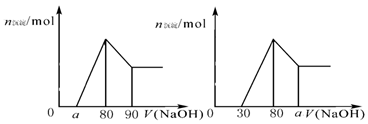
图A 图B 图C
A.
的取值范围为0≤ a<50
B.
的最大值为2.5
C.若将关系图改为B图时,则
的取值范围为80<a<90
D.若将关系图改为C图时,则
的取值范围为75<a<90
难度: 中等查看答案及解析