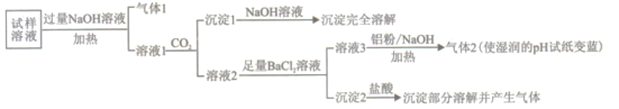
-
下列实验操作规范且能达到目的的是
目的
操作
A
鉴别CO2和SO2气体
将气体分别通入硝酸酸化的BaCl2溶液
B
制备氢氧化铁胶体
向沸水中一次加入大量的FeCl3饱和溶液
C
检验蔗糖水解产物中是否含有葡萄糖
在蔗糖溶液中加入3-5滴稀硫酸,煮沸几分钟,冷却后加入银氨溶液,在水浴中加热
D
比较Fe3+和Cu2+对H2O2分解得催化效果
向两支装有2mL5%H2O2溶液的试管中分别滴入0.1mol/L FeCl3和CuSO4溶液各1mL
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
使用下列食品添加剂不会改变原分散系种类的是
A. 乳化剂 B. 防腐剂 C. 增稠剂 D. 凝固剂
难度: 简单查看答案及解析
-
化学与生活密切相关。下列说法错误的是
A. FeCl3溶液可用于应急止血
B. 尿素[CO(NH2)2]可用作氮肥
C. 玻璃钢可用于制造汽车挡风破璃
D. 肥皂水可用于清洗蚊虫叮咬处
难度: 简单查看答案及解析
-
“富勒烯“材料家族包括C60、C70、N60、B40,下列说法正确的是
A. B40和C70都属于新型化合物 B. B40、C60、C70、N60分子内都只含共价键
C. C60和C70属于同分异构体 D. B40、C60、C70、N60都属于烯烃
难度: 简单查看答案及解析
-
下列说法确的是
A. 水可用来鉴别溴苯和苯
B. 聚苯乙烯不能发生加成反应
C. 用于杀菌消毒的医用酒精质量分数为95%
D. 植物油,动物脂肪和甘油都属于油脂
难度: 简单查看答案及解析
-
下列对化学用语的描述错误的是( )
A. 钠原子结构示意图:
 B. 硫离子的电子式:
B. 硫离子的电子式:C. HClO的结构式:H-O-Cl D. 乙酸的比例模型:

难度: 简单查看答案及解析
-
Yohiaki Nakao报道
 (b)在Pd催化下可发生Buchwald-Hartwig偶联反应。下列说法不正确的是
(b)在Pd催化下可发生Buchwald-Hartwig偶联反应。下列说法不正确的是A. b的分子式为C18H12N2O2
B. b的一氯代物有4种
C. b可发生取代反应
D. b的所有原子不一定共平面
难度: 中等查看答案及解析
-
2SO2(g)+O2(g)=2SO3(g) ΔH=-198kJ/mol,在V2O5存在时,该反应的机理为:V2O5+SO2
2VO2+SO3(快) 4VO2+O2
2V2O5(慢)
下列说法正确的是
A. 反应速率主要取决于V2O5的质量 B. VO2是该反应的催化剂
C. 逆反应的活化能大于198kJ/mol D. 增大SO2的浓度可显著提高反应速率
难度: 中等查看答案及解析
-
阿伏加德罗常数的值为NA,下列说法正确的是
A. 用惰性电极电解KOH溶液,若阳极产生5.6L气体,则电路中通过0.5NA电子
B. 常温常压下.4.6gNO2气体所含的分子数为0.1NA
C. 7.8gNa2O2与足量的水(H218O)反应生成的氧气所含的中子数为NA
D. 100g46%甲酸(HCOOH)水溶液所含的氧原子数为5NA
难度: 中等查看答案及解析
-
右表为周期表的一部分,其中X、Y、W、Z为短周期元素,T单质常温下为液体。下列说法错误的是
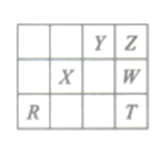
A. X、Y是形成生命物质的重要元素
B. Y、Z元素氢化物的稳定性依次递增
C. 工业上电解NaW溶液得W2可使用阴离子交换膜
D. R可用于制造半导体材料
难度: 中等查看答案及解析
-
0.10mol/L HA(Ka=10-9.89)溶液,调节溶液pH后。保持[HA] + [A-]=0.10mol/L。下列关系正确的是
A. pH=2.00时,[HA] > [H+]> [OH-] > [A-]
B. pH=7.00时,[HA] = [A-] > [OH-]= [H+]
C. pH=9.89时,[HA] = [A-] > [OH-]> [H+]
D. pH=14.00时,[OH-]>[A-]>[H+]>[HA]
难度: 中等查看答案及解析
-
中科院董绍俊课题组将二氧化锰和生物质置于一个由滤纸制成的折纸通道内形成电池(如图所示),该电池可将可乐(pH=2.5)中的葡萄糖作为燃料转化成葡萄糖内酯并获得能量。下列说法正确的是( )
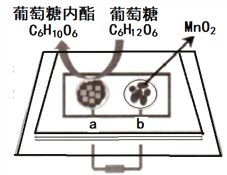
A. a极为正极
B. 随着反应不断进行,负极区的pH不断增大
C. b极的电极反成为:MnO2+2H2O+2e-=Mn2++4OH-
D. 当消耗0.01mol葡萄糖时,电路中转移0.02mol电子
难度: 中等查看答案及解析
-
实验室采用HCl气体“置换”除水,升华相结合的方法从市售的氯化锌制备高纯度无水氯化锌,装置如图所示[市售氯化锌含Zn(OH)Cl]。下列说法不正确的是
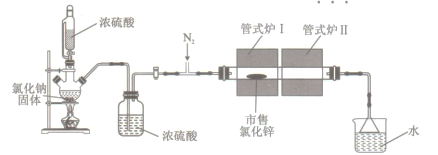
A. 恒压漏斗的作用是平衡气体压强
B. 管式炉Ⅰ采取的升温方式是阶段式升温
C. 实验时,应先撒去管式炉Ⅰ,再撤去管式炉Ⅱ
D. 在尾气吸收装置前应增加一个干燥装置
难度: 中等查看答案及解析
-
短周期元素T、Q、R.、W原子序数依次增大,其组成物质可进行下列转化:金属单质A与气体单质B加热反应生成M,M具有硬度高、耐高温等特点,易与常见液体D反应,生成刺激性气味气体E能使湿润的红色石蕊试纸变蓝 。A不溶于碱溶液但可与E在加热条件下反应得到M。下列说法正确的是
A. 化合物M是一种新型无机非金属材料氮化铝
B. Q元素组成的单质常温下较稳定
C. R元素组成的单质A又称作“国防金属”
D. A与E反应中,每生成0.1molM可得气态产物3.36L(标准状况)
难度: 中等查看答案及解析
-
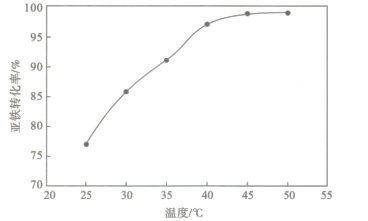
一定条件下合成乙烯:6H2(g)+2CO2(g)
CH2=CH2(g) +4H2O(g)。已知温度对CO2的平衡转化率和催化剂催化效率的影响如右下图。下列说法正确的是
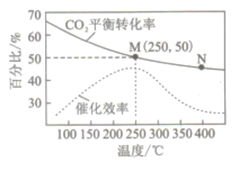
A. M点的正反应速率v正大于N点的逆反应速率v逆
B. 若投料比n(H2) :n(CO2) =4:1,则图中M点己烯的体积分数为5.88%
C. 250℃,催化剂对CO2平衡转化率的影响最大
D. 当温度高于250℃,升高温度,平衡逆向移动导致催化剂的催化效率降低
难度: 中等查看答案及解析