-
化学与科学、技术、社会、环境密切相关。下列有关说法中不正确的是
A.煤经过气化和液化两个物理变化,可变为清洁能源
B.服用铬含量超标的药用胶囊会对人体健康造成危害
C.以NO和NO2为主的氮氧化物是形成光化学烟雾和酸雨的一个重要原因
D.高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路”
难度: 简单查看答案及解析
-
2012年3月新修订的《环境空气质量标准》增设了PM 2.5(直径小于或等于2.5微米的颗粒物)浓度限值、臭氧8小时平均浓度限值。下列有关说法正确的
A.PM 2.5所指颗粒物大小与胶体中分散质粒子大小相当
B.O2和O3互为同素异形体,两者的化学性质相同
C.O3转化为O2和O2转化为O3过程中均有能量变化
D.反应3O2=2O3有单质参加,属于氧化还原反应
难度: 简单查看答案及解析
-
下列说法不正确的是
A.Na2O2、HClO、SO2等物质都具有漂白作用
B.液氨、液氯、液态氯化氢都是电解质
C.所有的置换反应都是氧化还原反应,而所有的复分解反应都是非氧化还原反应
D.非金属氧化物不一定是酸性氧化物,有些金属氧化物也能与强碱反应
难度: 简单查看答案及解析
-
某物质的水溶液能导电,且该物质属于非电解质,溶于水化学键被破坏的是
A.液溴 B.干冰 C.蔗糖 D.硫酸钡
难度: 中等查看答案及解析
-
下列说法或表示方法正确的是
A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由C(石墨)===C(金刚石);ΔH=+1.90kJ·mol-1可知金刚石比石墨稳定
C.在101kPa时,2g H2完全燃烧生成液态水放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)==2H2O(l);ΔH=-285.8kJ·mol-1
D.在稀溶液中,H+(aq)+OH-(aq)==H2O(l);ΔH=-57.3kJ·mol-1,若将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量大于57.3kJ
难度: 中等查看答案及解析
-
下列叙述与胶体无关的是
A.胶体分散质的微粒直径在10-9m~10-7m之间
B.当日光从窗隙射入暗室时,可观察到一束光亮的通路
C.胶体微粒具有较大的表面积,能吸附阳离子或阴离子
D.向氯化铁溶液中加入氢氧化钠溶液,产生红褐色沉淀
难度: 简单查看答案及解析
-
短周期非金属元素原子核外最外层电子数是次外层电子数的一半,该元素
A.在自然界中只以化合态的形式存在
B.单质常用作半导体材料和光导纤维
C.最高价氧化物不与酸反应
D.气态氢化物比甲烷稳定
难度: 中等查看答案及解析
-
下列说法中不正确的是
A.对于任何化学反应来说,反应速率越大,反应现象就越明显
B.在其他条件不变时,升高温度一定会加快化学反应的反应速率
C.使用合理的催化剂,可以改变化学反应速率,但不能改变化学平衡状态
D.增大反应物浓度,可使单位体积内活化分子数增加,反应速率加快
难度: 简单查看答案及解析
-
金属钛对体液无毒且惰性,能与肌肉和骨骼生长在一起,有“生物金属”之称。下列有关
的说法中正确的是
A.
原子中均含有22个中子
B.
为同一核素
C.
互称同位素,在周期表中位置相同,都在第4纵行
D.分别由
组成的金属钛单质互称为同分异构体
难度: 中等查看答案及解析
-
甲溶液的pH是4,乙溶液的PH是5,甲溶液与乙溶液的c(H+)之比为
A.10:1 B.1:10 C.2:1 D.1:2
难度: 中等查看答案及解析
-
下列推断正确的是
A.SiO2 是酸性氧化物,能与NaOH溶液反应
B.Na2O、Na2O2组成元素相同,与 CO2反应产物也相同
C.CO、NO、NO2都是大气污染气体,在空气中都能稳定存在
D.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色
难度: 中等查看答案及解析
-
据报道,科学家开发出了利用太阳能分解水的新型催化剂。下列有关水分解过程的能量变化示意图正确的是
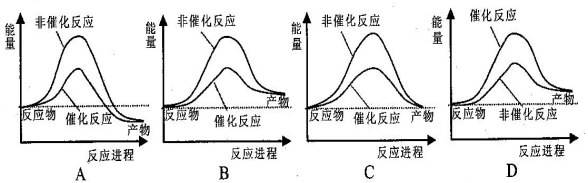
难度: 中等查看答案及解析
-
已知还原性:Cl—<Br—<Fe2+<I—<SO2,由此判断下列反应必然发生的是
①2Fe3++SO2+2H2O=2Fe2++SO42—+4H+
②I2+SO2+2H2O=4H++ SO42—+2I—
③2Fe2++I2=2Fe3++2I—
④2Br—+4H++ SO42—=SO2↑+Br2+2H2O
A.①② B.②③ C.③④ D.①④
难度: 中等查看答案及解析
-
下列有关说法正确的是(NA为阿伏加德罗常数)
A.1.00molNaCl中含有NA个NaCl分子
B.欲配制1.00L,1.00mol.L-1的NaCl溶液,可将 58.5gNaCl溶于 1.00L水
C.1.12L Cl2含有1.7NA个质子
D.1molCl2与足量的铁反应,转移的电子数为2NA
难度: 中等查看答案及解析
-
常温下,下列盐溶于水时,能使水的电离程度增大且c(H+)也增大的是
A.NaHSO4 B.KAl(SO4)2 C.NaHCO3 D.CH3COONa
难度: 中等查看答案及解析
-
等体积等浓度的MOH强碱溶液和HA弱酸溶液混和,溶液中离子浓度关系不正确的是
A.c(M+)=c(HA)+c(A-) B.c(M+)>c(H+)>c(A-)>c(OH-)
C.c(OH-)=c(H+)+ c(HA) D.c(M+)+c(H+) =c(OH-)+c(A-)
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是
A.pH=1的溶液中:Fe2+、NO3-、SO42-、Na+
B.由水电离的c(H+)=1×10-14 mol·L-1的溶液中:Ca2+、K+、Cl-、HCO3-
C.c(H+)/c(OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl-
D.c(Fe3+)=0.1 mol·L-1的溶液中:K+、ClO-、SO42-、SCN-
难度: 中等查看答案及解析
-
Na2CO3水溶液中存在CO32-+H2O
HCO3-+OH-平衡。下列说法不正确的是
A.稀释溶液,
增大
B.通入CO2,溶液pH减小
C.升高温度,此平衡常数增大
D.加入NaOH固体,
减小
难度: 中等查看答案及解析
-
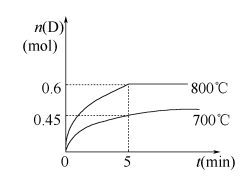
在温度相同,压强分别为P1和P2的条件下,A(g)+2B(g)
nC(g)的反应体系中,C的百分含量(c%)与时间t的曲线如右图所示,下面结论正确的是
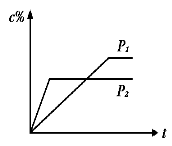
A.P1>P2,n<3 B.P1<P2,n>3
C.P1>P2,n>3 D.P1<P2,n<3
难度: 中等查看答案及解析
-
向100mL pH=0的硫酸和硝酸混合溶液中投入3.84g铜粉,微热使反应充分完成后,生成NO气体448mL(标准状况)。则反应前的混合溶液中含硝酸的物质的量为
A.0.02mol B.0.08mol C.0.10mol D.0.16mol
难度: 困难查看答案及解析
-
下列有关实验的叙述中,合理的是
A.用碱式滴定管量取25.00mL溴水
B.不宜用瓷坩埚灼烧氢氧化钠或碳酸钠
C.测定溶液的pH值时用干燥、洁净的玻璃棒蘸取溶液,滴在用蒸馏水湿润过的pH试纸上,再与标准比色卡比较
D.圆底烧瓶、锥形瓶、烧杯加热时都应垫在石棉网上
E.使用容量瓶配制溶液时,俯视刻度线定容后所得溶液浓度偏高
F.配制硫酸溶液时,可先在量筒内加入一定体积的水,再在搅拌下慢慢加入浓硫酸
难度: 中等查看答案及解析