-
化学与环境、能源密切相关,下列叙述不正确的是
A. 燃煤产生的PM2.5(2.5微米以下细颗粒物)属于大气污染物
B. 开发利用各种新能源,可以减少对化石燃料的依赖
C. 废电池必须进行集中处理,其首要原因是利用电池外壳的金属材料
D. “富煤、贫油、少气”是我国能源发展面临的现状,解决的办法是开源节流
难度: 简单查看答案及解析
-
下列有关原电池的说法不正确的是
A. 锌锰干电池中锌电极是负极,工作时锌被还原
B. 锌与稀硫酸反应时,加入少量硫酸铜溶液可使反应加快
C. 燃料电池的电极本身不包含活性物质,其燃料和氧化剂由外部供给
D. 判断一种电池的优劣主要看其比能量、比功率以及可储存时间的长短
难度: 简单查看答案及解析
-
下列关于电解的说法正确的是
A. 工业上通常用电解饱和食盐水生产金属钠,电解熔融氯化铝冶炼铝
B. 电镀时,通常把待镀的金属制品做阳极
C. 电解法精炼铜时,其含有的Zn、Fe、Ni、Ag、Au等杂质沉积在电解槽的底部
D. 二次电池充电过程的实质是电解,充电时应将其负极与充电器电源的负极相连
难度: 简单查看答案及解析
-
下列说法正确的是
A. H2(g)的燃烧热△H=-285.8 kJ/mol,则2H2O(g)=2H2(g)+O2(g) △H=+571.6 kJ/mol
B. 反应物的总能量低于生成物的总能量时,该反应为放热反应
C. 由石墨比金刚石稳定可知:c(金刚石,s)=c(石墨,s) △H<0
D. 已知:298K时,N2(g)+3H2(g)
2NH3(g) △H =-92.0 kJ/mol。在相同温度下,向密闭容器中通入1/2 mol N2和3/2 mol H2,达到平衡时放出46.0 kJ的热量
难度: 简单查看答案及解析
-
用惰性电极电解稀HNO3、CuSO4和NaCl的混合液,最初一段时间阴极和阳极上分别析出的物质是
A. H2和Cl2 B. Cu和Cl2 C. H2和O2 D. Cu和O2
难度: 简单查看答案及解析
-
反应A(g)+3B(g)
2C(g)+2D(g),在不同条件下测得反应速率,其中速率最快的是
A.
(D)=0.4 mol /(L·s) B.
(C)=0.5 mol /(L·s)
C.
(B)=0.6 mol /(L·s) D.
(A)=0.15 mol /(L·s)
难度: 简单查看答案及解析
-
某温度下,浓度都是1.0mol/L的两种气体X2和Y2,在密闭容器中反应生成气体Z。10min后测得X2、Z的浓度分别为0.4mol/L、0.6mol/L,则该反应的化学方程式可能为
A. X2+2Y2
2XY2 B. 3X2+Y2
2X3Y
C. 2X2+Y2
2X2Y D. X2+3Y3
2XY3
难度: 简单查看答案及解析
-
其他条件不变时,改变下列条件,可以使活化分子百分数增加,从而加快反应速率的是
①增大反应物浓度 ②升高温度 ③加入正催化剂 ④增大压强(有气体参加)
A. ①② B. ①④ C. ②③ D. ③④
难度: 简单查看答案及解析
-
在恒温恒容的密闭容器中,对可逆反应2SO2(g)+O2(g)
2SO3(g),下列判断不正确的是
A. 达到化学平衡时,2
正(O2)=
逆(SO3)
B. 若单位时间内生成x molSO3的同时消耗x mol SO2,则反应达到平衡状态
C. 达到化学平衡时,容器中气体压强不再变化
D. 达到化学平衡时,容器中混合气体的平均相对分子质量不再变化
难度: 简单查看答案及解析
-
已知反应Na2S2O3+H2SO4=Na2SO4+S↓+SO2+H2O,下列各组实验中最先出现浑浊的是
组号
温度
Na2S2O3
H2SO4
H2O
体积
浓度
体积
浓度
体积
A
0℃
10mL
0.1 mol/L
10mL
0.1 mol/L
0mL
B
10℃
5mL
0.1 mol/L
5mL
0.1 mol/L
10mL
C
30℃
5mL
0.1 mol/L
5mL
0.1 mol/L
10mL
D
30℃
5mL
0.2 mol/L
5mL
0.2 mol/L
10mL
难度: 简单查看答案及解析
-
已知:H2(g)+F2(g)=2HF(g) △H=-539kJ/mol,若断裂1mol H—H键需吸收436kJ的能量,断裂1mol F—F键需吸收155kJ的能量,则断裂1 mol H—F键需吸收的能量为
A. 565kJ B. 282.5kJ C. 765kJ D. 380kJ
难度: 简单查看答案及解析
-
已知反应:H2(g)+
O2(g)=H2O(g) △H1
N2(g)+O2(g)=NO2(g) △H2
N2(g)+
H2(g)=NH3(g) △H3
则反应2NH3(g)+
O2(g)=2NO2(g)+3H2O(g)的△H为
A. 2△H1+2△H2-2△H3 B. △H1+△H2-△H3
C. 3△H1+2△H2+2△H3 D. 3△H1+2△H2-2△H3
难度: 简单查看答案及解析
-
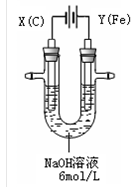
利用如图装置探究铁在海水中的电化学腐蚀与防护。下列说法不正确的是
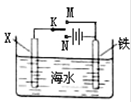
A. 若X为锌棒,开关K置于M处,可减缓铁的腐蚀,采用了牺牲阳极的阴极保护法
B. 若X为锌棒,开关K置于N处,X极的反应:4OH--4e-=O2↑+2H2O
C. 若X为碳棒,开关K置于N处,可减缓铁的腐蚀,采用了外加电流的阴极保护法
D. 若X为碳棒,开关K置于M处,X极的反应:O2+4e-+2H2O=4OH-
难度: 简单查看答案及解析
-
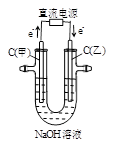
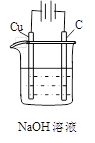
下列说法正确的是
A
B
C
D
通电一段时间后,搅拌均匀,溶液的pH不变
乙电极上的电极反应:2H++2e-=H2↑
电解初期总反应:
Cu+2H+
Cu2++H2↑
盐桥中的K+移向KI溶液
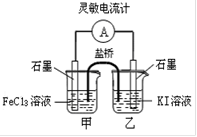
难度: 简单查看答案及解析
-
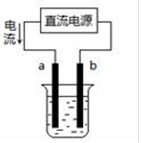
如下图,a、b是石墨电极,通电一段时间后,a极附近溶液显红色。下列说法不正确的是
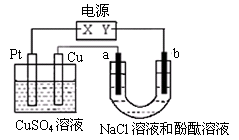
A. X极是电源负极,Y极是电源正极
B. b极的电极反应为:2Cl--2e-=Cl2↑
C. 电解过程中CuSO4溶液的浓度逐渐减小
D. Pt极上有6.4 g Cu析出时,a极产生2.24 L(标准状况)气体
难度: 简单查看答案及解析
-
对于在恒温的密闭容器中进行的反应:N2(g)+O2(g)=2NO(g),下列情况下该反应的化学反应速率保持不变的是
A. 缩小容器体积,使压强增大 B. 保持体积不变,充入O2
C. 保持体积不变,充入氦气 D. 保持压强不变,充入氦气
难度: 简单查看答案及解析
-
在400℃、101kPa时,NO2(g)+CO(g)=NO(g)+CO2(g)反应过程的能量变化如下图所示。下列说法不正确的是
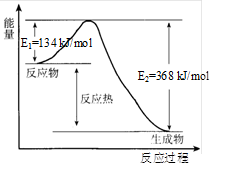
A. 该反应是放热反应
B. 该反应的反应热△H =-234 kJ/mol
C. 加入催化剂,使该反应的活化能降低,反应速率加快,同时使该反应的反应热数值减小
D. 由图可推出:NO(g)+CO2(g)
NO2(g)+CO(g)△H =+234 kJ/mol
难度: 简单查看答案及解析
-
下图所示的实验装置不能达到实验目的的是

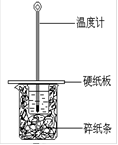
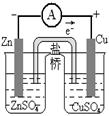

A. 结合秒表测量锌与硫酸的反应速率
B. 测定中和反应的反应热
C. 验证化学能转化为电能
D. 验证催化剂对反应速率的影响
难度: 简单查看答案及解析
-
高功率Ni/MH(M表示储氢合金,MH中的H可看作0价)电池已经用于混合动力汽车。总反应方程式如下:
Ni(OH)2+M
NiOOH+MH
下列叙述正确的是
A. 放电时正极附近溶液的碱性增强
B. 放电时负极反应为:M+H2O+e-=MH+OH-
C. 充电时阳极反应为:NiOOH+H2O+e-=Ni(OH)2+OH-
D. 放电时每转移1mol电子,正极有1mol NiOOH 被氧化
难度: 简单查看答案及解析
-
双酚A是食品、饮料包装和奶瓶等塑料制品的添加剂,能导致人体内分泌失调,对儿童的健康危害更大。下列有关双酚A的叙述不正确的是
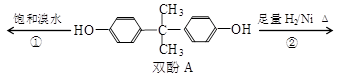
A. 双酚A的分子式是C15H16O2
B. 双酚A的核磁共振氢谱显示氢原子数之比是1:2:2:3
C. 反应①中,1 mol双酚A最多消耗2 mol Br2
D. 反应②的产物中只有一种官能团
难度: 简单查看答案及解析
-
以石墨电极电解200 mL CuSO4溶液,电解过程中产生气体体积V(g)(标准状况)与电子转移物质的量n(e-)的关系如下图所示,n(e-)=0.8 mol时停止电解。下列说法中正确的是
A. 电解前CuSO4溶液的物质的量浓度为2 mol/L
B. 当n(e-)=0.6 mol时,V(H2)∶V(O2)=2∶3
C. 电解后所得溶液中c(H+)=2 mol/L
D. 向电解后的溶液中加入16 g CuO,则溶液可恢复为电解前的浓度
难度: 简单查看答案及解析
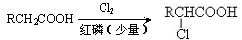
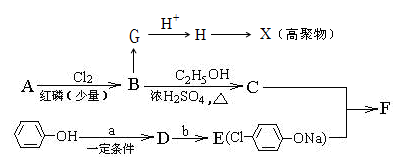
 ),反应的化学方程式是:
),反应的化学方程式是: