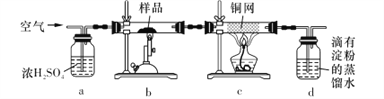
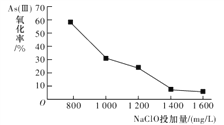
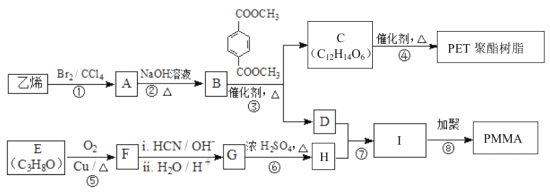
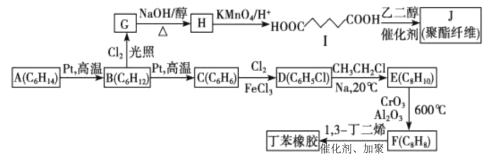
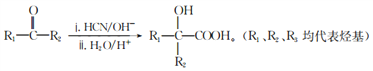-
公元前,有一位厨师不小心把刚熬好的羊油碰翻在灶坑旁,与草木灰混在一起,当他将羊油与草木灰的混合物用手捧出去后,洗手时发现手洗得特别干净。对此下列解释正确的是
A. 羊油是一种有机溶剂,溶解了厨师手上的油污
B. 草木灰呈碱性,与羊油发生了中和反应,除去油污
C. 羊油与草木灰中的物质发生了加成反应,除去油污
D. 羊油在碱性草木灰(K2CO3)的作用下发生了皂化反应,生成具有去油污能力的物质
难度: 中等查看答案及解析
-
在复杂的体系中,确认化学反应先后顺序有利于解决问题。下列化学反应先后顺序判断正确的是 ( )
A. 在含有等物质的量的AlO2-、OH-、CO32-溶液中,逐滴加入盐酸:AlO2-、OH-、CO32-
B. 在含等物质的量的FeBr2、FeI2溶液中,缓慢通人氯气:I-、Br-、Fe2+
C. 在含等物质的量的KOH、Ba(OH)2溶液中,缓慢通入CO2: KOH、Ba(OH)2、K2CO3、BaCO3
D. 在含等物质的量的Fe3+、Cu2+、H+溶液中加入锌粉:Fe3+、Cu2+、H+
难度: 中等查看答案及解析
-
“春回大地、福满人间”,在春节生活中,化学材料有着重要的应用。下列叙述正确的是
A. 健康的春节生活中,我们平衡吸收的“六大营养素”包括糖类、油脂、蛋白质、水、无机盐、维生素,还要合理食用膳食纤维
B. 家庭用的塑料水杯、盛装植物油的塑料容器都是用聚氯乙烯制成的
C. 白酒中混有少量的塑化剂,少量饮用对人体无害,可通过过滤方法除去
D. 我们乘坐的小汽车排放的尾气中含有氮的氧化物,是汽油不完全燃烧产生的
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.2.8g C2H4和C3H6的混合物中含碳原子数为0.2×6.02×1023
B.在O2参与的反应中,1 mol O2做氧化剂时,得到电子数一定是4×6.02×1023
C.1 L 0.1 mol/L 的Na2S溶液中硫离子数为0.1×6.02×1023
D.标准状况下,11.2 L乙醇中氧原子数为0.5×6.02×1023
难度: 中等查看答案及解析
-
25℃时,向体积为 10 mL 的 0.1 mol/LNaOH溶液中逐滴加入0.1mol/LCH3COOH溶液,曲线如图所示。下列有关离子浓度关系的比较中,错误的是
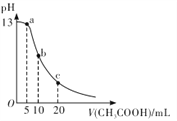
A. a点处:c( Na+)>c(CH3COO-)>c(OH-)>c(H+)
B. b点处:c(CH3COOH)+c(H+ )=c(OH-)
C. c点处:c(CH3COOH)+c(CH3COO-)=2c(Na+)
D. NaOH溶液和CH3COOH溶液以任意比混合时:c( Na+)+c(H+)=c(OH-)+(CH3COO-)
难度: 中等查看答案及解析
-
研究人员发明了一种“海水”电池,其电池总反应可表示为5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl。下列有关说法正确的是
A. 正极反应式:Ag+Cl--e-=AgCl
B. 每生成1 mol Na2Mn5O10转移2 mol电子
C. Na+不断向“海水’’电池的负极移动
D. 电子从电池的正极经外电路流向电池的负极
难度: 中等查看答案及解析
-
现有:乙醇、乙醛、乙酸、乙酸乙酯、甲酸、甲酸甲酯、苯、四氯化碳八种失去标签的试剂,只用一种试剂进行鉴别(可以加热),这种试剂是
A. 溴水 B. 新制的Cu(OH)2悬浊液
C. 酸性高锰酸钾溶液 D. FeCl3溶液
难度: 中等查看答案及解析
-
1,3-丁二烯(CH2=CH—CH=CH2)和2-丁炔(CH3—C≡C—CH3)是有机合成工业中常用的不饱和烃原材料,分别与氢气反应的热化学方程式如下:
CH2=CH—CH=CH2(g)+2H2(g)→CH3CH2CH2CH3(g) ΔH=-236.6 kJ·mol-1
CH3—C≡C—CH3(g)+2H2(g)→CH3CH2CH2CH3(g) ΔH=-272.7 kJ·mol-1
下列说法错误的是( )
A. 可计算出1,3-丁二烯和2-丁炔相互转化的焓变ΔH
B. 可比较1,3-丁二烯和2-丁炔分子的稳定性
C. 可比较1,3-丁二烯和2-丁炔的燃烧热热值的相对大小
D. 可计算出2-丁炔中一个碳碳三键的键能与1,3-丁二烯中两个碳碳双键键能之和的差值
难度: 中等查看答案及解析
-
某温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B进行反应3A(g)+2B(g)
4C(s)+2D(g)。反应一段时间后达到平衡,测得生成1.6 mol,且反应前后的压强之比为5:4(相同的温度下测量),则下列说法正确的是
A. 该反应的化学平衡常数表达式是
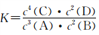
B. 此时B的平衡转化率是40%
C. 增大该体系的压强,平衡向右移动,化学平衡常数增大
D. 其他条件不变时,增大B的浓度,B的平衡转化率不变
难度: 中等查看答案及解析
-
常温下,对下列电解质溶液的有关说法一定正确的是
A. 相同浓度和体积的强碱和强酸溶液混合后,溶液的pH —定等于7
B. 在NaHCO3溶液中,c(CO32-)>c(HCO3-)
C. 在有AgCl沉淀的溶液中加入NaCl固体,c(Ag+)减小
D. 将pH相同的CH3COONa和NaOH溶液稀释相同的倍数,CH3COONa溶液的pH较小
难度: 中等查看答案及解析
-
如图是一种锂钒氧化物热电池装置,电池总反应为xLi + LiV3O8 = Li1+xV3O8。工作时,需先引发铁和氯酸钾反应使共晶盐融化。已知: LiCl-KCl共晶盐熔点352℃。下列说法正确的是
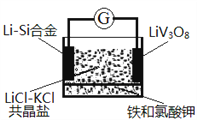
A. 整个过程的能量转化只涉及化学能转化为电能
B. 放电时正极反应为:Li1+xV3O8–xe‾=LiV3O8+xLi+
C. 放电时Cl‾ 移向LiV3O8电极
D. Li-Si合金熔点高于352℃
难度: 中等查看答案及解析
-
下列化学用语或有关物质性质的描述正确的是
A. 如上图所示的键线式表示的烃的名称为:3-甲基-4-乙基-7-甲基辛烷
B. 符合分子式C3H8O的醇有3种不同的结构
C. 乙烯在一定条件下能发生加成反应、加聚反应,还能被酸性高锰酸钾溶液氧化
D. 治疗疟疾的青蒿素的结构简式为
 ,分子式是Cl5H20O5
,分子式是Cl5H20O5难度: 中等查看答案及解析
-
在四个恒容密闭容器中按左下表相应量充入气体,发生反应2N2O(g)
2N2(g)+O2(g),容器Ⅰ、Ⅱ、Ⅲ中N2O的平衡转化率如下图所示:
容器
容积/L
起始物质的量/mol
N2O
N2
O2
Ⅰ
V1
0.1
0
0
Ⅱ
1.0
0.1
0
0
Ⅲ
V3
0.1
0
0
Ⅳ
1.0
0.06
0.06
0.04
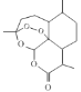
下列说法正确的是
A. 该反应的正反应放热
B. 相同温度下反应相同时间,平均反应速率:v(Ⅰ)>v(Ⅱ)
C. 容器Ⅳ在470℃进行反应时,起始反应速率:v正(N2O)<v逆(N2O)
D. 图中A、B、C三点处容器内总压强:pA(I)< pB(Ⅱ)<pC(Ⅲ)
难度: 中等查看答案及解析
-
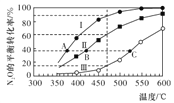
某二次电池充、放电的化学方程式为2K2S2+KI3
K2S4+3KI,其与充电其他设备连接的电路如图所示。当闭合开关K时,电极X附近溶液先变红。则下列说法正确的是
A. 放电时,电极A发生还原反应
B. 电极A的电极反应式为3I--2e-=I3-
C. 当有0.1mol K+通过阳离子交换膜时,电极X上产生气体1.12 L(标准状况下)
D. 电池充电时,电极B要与外电源的正极相连,电极上发生还原反应
难度: 中等查看答案及解析
-
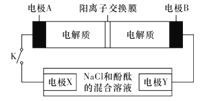
某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),设计了如下流程:
下列说法不正确的是
A. 溶液1中的阳离子可与NH4+、HCO3-、I-、SO42-在同一溶液中大量共存
B. 向溶液2中加入3-5滴K3[Fe(CN)6](铁氰化钾)溶液,可观察到有蓝色沉淀生成
C. 向固体2中加入足量NaOH溶液,发生反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O
D. 从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解
难度: 中等查看答案及解析
-
某企业以辉铜矿为原料生产碱式碳酸铜,工艺流程如下所示:

已知:[Cu(NH3)4]2+(aq)
Cu2+(aq) + 4NH3(aq)根据以上工艺流程,下列说法不正确的是
A.气体X中含有SO2
B.为实现溶液C到溶液D的转化,加NH3·H2O至红棕色沉淀刚好完全,过滤即可
C.蒸氨过程发生总反应的化学方程式为:[Cu(NH3)4 ]Cl2 + H2O
CuO + 2HCl↑+ 4NH3↑
D.在制备产品时,溶液D中不直接加入Na2CO3溶液的原因是游离的Cu2+浓度太低
难度: 困难查看答案及解析